麦芽糖转运相关基因的表达对刺糖多孢菌生长及多杀菌素合成的影响
- 时间:2016-09-08
黄颖 赵晨 张求学 宋渊 张晓琳
多杀菌素(spinosad)是土壤放线菌刺糖多孢菌(Saccharopoly sporaspinosa)经有氧发酵产生的一类胞内次级代谢产物,是具有高效触杀及摄食毒性的新型微生物源杀虫剂(Thompson et al., 2000;White et al., 2007;Raymond et al., 2005;Millar, Denholm,2007)。多杀菌素属于大环内酯类化合物,由一个21碳的大环内酯连接着两个糖基:福乐糖胺(D-(+)-Forosamine)和鼠李糖(L-Rhamnose);多杀菌素有多个组分,不同组分的区别主要在于福乐糖胺和母核上几个位置的取代基不同,其中A和D组分具有主要的活性,其比重分别为85%~88%和12%~15%,是商业化产品的主要成分(Kirst et al., 1992;Sparkset al., 2001)。由于兼具生物农药的安全性和化学合成农药的速效性,多杀菌素曾3次获得美国“总统绿色化学品挑战奖”(Holt et al., 2006;Cleveland et al., 2001)。多杀菌素已被批准在多种大田作物上使用,还可有效防治多种储粮害虫,并在防治动物(宠物和家畜)寄生虫、头虱(Pediculus humanuscapitis)等方面具有极大的应用价值和广阔的市场前景(Semiz et al., 2006;Musser,shelton,2005;Joneset al., 2005;Marina et al., 2014)。但目前我国多杀菌素的工业化生产还存在着发酵单位低、生产成本高等问题,因此选育高产菌株、优化发酵工艺是当前的主要研究目标。
淀粉是工业化发酵的主要碳源,来源丰富,成本低廉。许多产抗生素链霉菌的发酵都具有葡萄糖抑制效应,所以大多数链霉菌发酵培养基中的碳源都以淀粉类的长效碳源为主。在配置培养基的过程中,淀粉一般要经过α-淀粉酶糊化,加热灭菌等步骤,从而被转化为麦芽糖,麦芽三糖,麦芽糊精,淀粉和少量葡萄糖的混合物。淀粉和麦芽糊精可以进一步被菌体分泌到胞外的淀粉酶消化生成短链的糖。细胞膜上的麦芽糖/麦芽糊精转运系统是一个高效的ABC周质结合蛋白转运系统,专门负责吸收和代谢α(1-4)糖苷键的葡萄糖聚合物(从2个单元的麦芽糖至7~8个单元的麦芽糊精)(Higgins,2001;Oldham et al., 2007)。在大肠杆菌(Esch⁃erichia coli)中,麦芽糖通过外膜进入周质,遇到麦芽糖转运系统基因E(maltose transportergene E,malE)编码的周质结合蛋白发生可逆性结合,MalE构象改变,进而与跨膜运输蛋白麦芽糖转运系统跨膜运输蛋白F亚基、g亚基和两个K亚基(maltosetransporter FGK2, MalFGK2)发生作用,水解ATP而使得麦芽糖进入胞浆。跨膜运输蛋白由两个跨膜蛋白(MalF和MalG)以及两个ATP水解亚单元(MalK)组成(Schneider, Hunke, 1998)。
刺糖多孢菌对淀粉和麦芽糖的利用能力较低(王超,2009),在以淀粉为主要碳源的培养基中菌株生长缓慢,多杀菌素产量低,这为工业化生产多杀菌素带来了困难。阿维链霉菌(Streptomycesaver⁃mitilis)能够利用高浓度的淀粉作为单一碳源,其对淀粉和麦芽糖的利用都是通过麦芽糖转运系统完成的。在阿维链霉菌中通过对麦芽糖转运系统基因EFG(maltose transportergene EFG, malEFG)缺失互补实验表明,malEFg对于菌体利用麦芽糖是必需的,而过量表达malEFg基因能够促进阿维菌素产量的提高,并缩短其发酵周期(李萌,2008)。因此本研究在刺糖多孢菌中表达阿维链霉菌麦芽糖转运系统malEFg基因,以提高刺糖多孢菌对淀粉的利用能力,为多杀菌素的发酵生产提供指导。
1 材料与方法
1.1 菌株
刺糖多孢菌(Saccharopolyspora spinosa)高产突变株ASAGF73由国家粮食局科学研究院发酵生物技术实验室选育和保藏(陈园等,2013),刺糖多孢菌ASAGF73pSET152::malEFg为本研究构建的重组菌株。接合转移供体菌株大肠杆菌(Escherichia coli) ET12567由中国农业大学生物学院陈芝赠与。麦芽糖转运系统基因(maltose transportergene EFG,malEFG)malE、malF 和malg的表达载体pSET152::malEFG由中国农业大学生物学院李萌惠赠,其构建过程是将阿维链霉菌的malEFg基因克隆到整合型表达载体pSET152中(李萌等,2014)。
1.2 培养基
大肠杆菌培养基为LB培养基(胰蛋白胨10g,酵母膏5g, NaCl 10g,加蒸馏水至1L);刺糖多孢菌的固体产孢培养基为GYM培养基(葡萄糖4g,麦芽提取物4g,酵母提取物10g,碳酸钙2g,琼脂12g,加蒸馏水至1L),液体培养用TSB培养基(Kieser et al., 2000),种子和发酵培养基及培养条件按照陈园等(2013)的方法进行。
1.3 生物信息学分析
通过GenBank在线BLAST比对,找出刺糖多孢菌中与阿维链霉菌MalEFG和MisK同源的蛋白。
1.4 重组菌株的构建
将pSET152::malEFg通过接合转移的方法转化高产菌株ASAGF73,获得转化菌株ASAGF73pSET152::malEFG。刺糖多孢菌的接合转移参照Kieser等(2000)的方法。根据pSET152质粒上安普霉素抗性基因aprR的序列[AJ414670.1(1729..2505)]设计合成PCR引物(由Invitrogen合成),用于验证转化子:
Apr-F:5'-CGAGCTCATCGGTCAGCTTC-3';
Apr-R:5'-CTGGCGGATGCAGGAAGATC-3'。
以转化子基因组DNA为模板进行PCR。PCR反应体系(25μL):2×GC buffer I (TAKARA)12.5μL,dNTP(2.5mmol/L)2μL,上下游引物(20mmol/L)各0.5μL,模板DNA(200ng/μL)0.25μL,LaTaq DNA聚合酶(5U/L)0.25μL,用ddH2O补至25μL。PCR扩增条件:95℃4min;95℃30s,62℃30s,72℃1min,25个循环;72℃5min;4℃保温。将PCR产物进行电泳检测。基因组DNA的提取根据Promega Wizardgenomic DNA Purification kit的说明书进行。
1.5 刺糖多孢菌总RNA的提取和qRT-PCR
将ASAGF73及其pSET152::malEFg转化子按照陈园等(2013)的方法进行发酵,收集发酵第48和144h时的菌丝体,用预冷的生理盐水洗涤一遍后通过TRIZOL法提取总RNA(黄颖等,2014),用Ambion TURBO Recombinant DNase Ⅰ (RNase-Free) (ABI,美国)处理。取2μg无DNA污染的RNA合成cDNA,具体步骤参照反转录酶SuperScriptⅢ Reverse Transcriptase (Invitrogen,美国)试剂盒说明书进行。根据NCBI上阿维链霉菌(Strep⁃tomycesavermitilis)ATCC31267中malEFg基因的序列信息[NC_003155.4(7195314..7198638)],设计引物扩增malE、malF、malg基因中的100~150bp的片段,退火温度均在60℃以上,引物信息如下:
malE-F-RT:5'-TCGACCAGGCGCAGAACAAG-3';
malE-R-RT:5'-CGTCCAGCGGCAGGAAGTAG-3'。
malF-F-RT:5'-CGCGTCAAGAACGGCTACCA-3';
malF-R-RT:5'-CGTCGGTCAGGGTCAGGTAG-3'。
malG-F-RT:5'-CGTACAGCGCCTGGTTGCTC-3';
malG-R-RT:5'-GATCAGFFGGAAGAAGGTGC-3'。
qRT-PCR反应体系(20μL):cDNA模板(1ng/μL)9μL,正反向引物(20μmol/L)各0.5μL,2×PowerSYBRgreen PCR master mix(ABI,美国)10μL。在ABI 7500 Real-time PCRsystem上进行反应,qRTPCR条件:95℃10min;95℃15s,60℃1min,共40个循环。以刺糖多孢菌中的主要sigma因子sigA为内参,每个实验组均设3个重复。依据双标准曲线法(徐丽华等,2011)计算实验结果和标准偏差。
1.6 刺糖多孢菌转化子的单一碳源发酵培养
转化菌株ASAGF73 pSET152::malEFg在含有安普霉素的抗性平板上转接两次后,进行单一碳源发酵实验。在陈园等(2013)的摇瓶发酵培养基配方的基础上,去掉原有的所有碳源,分别以60g/L葡萄糖、糊精或麦芽糖为单一碳源进行发酵。将刺糖多孢菌ASAGF73及其转化子接种到种子培养基中,于28℃240r/min培养48h,再以10%的接种量接入3种单一碳源发酵培养基中,每组设3个重复,28℃240r/min培养168h。在发酵的第48和144h时取样检测。
1.7 多杀菌素的检测
取4mL发酵液与甲醇按照1∶1比例混合,剧烈震荡混匀,静置过夜,4000r/min离心20min,取上清进行高效液相色谱法(high performance liquid chromatography, HPLC)测定,计算积分面积值,利用标准曲线的线性方程计算多杀菌素的发酵产量。HPLC检测条件:色谱柱为C18反相柱(Agilent,中国),150mm×4.6mm,5μm;流动相为甲醇∶乙腈∶0.05%乙酸铵水溶液=45∶45∶10;进样量为10μL;流速为1mL/min;柱温为25℃;检测波长为244nm。
1.8 发酵液测定
1.8.1 发酵液生物量测定
取发酵液8mL置于离心管中,4000r/min离心15min,测定菌体占发酵液重量的百分比。具体计算公式为(菌体沉淀的重量-10mL离心管的重量)∕(8mL发酵液重量-10mL离心管的重量)。
1.8.2 发酵液中还原糖的测定
利用山东省科学院生物所开发的SGD-IV型全自动还原糖测定仪进行测定。具体操作依据说明书进行。
2 结果与分析
2.1 刺糖多孢菌和阿维链霉菌中与麦芽糖转运
系统相关的同源蛋白序列比对麦芽糖转运系统由周质结合蛋白MalE和跨膜运输蛋白MalFGK2组成。在天蓝色链霉菌(Strept⁃omycescoelicolor)中存在malEFg同源基因,与malK功能相同的msiK和malEFg基因在染色体上的距离较远,除了为运输麦芽糖提供能量之外,还为纤维二糖和木二糖的跨膜运输提供ATP(Schlosser et al., 1997)。通过生物信息学分析发现,刺糖多孢菌中具有一个和阿维链霉菌同源性较高的多种糖类转运蛋白K(multiplesugar import protein K, MsiK),而阿维链霉菌的MalE、MalF和MalG蛋白在刺糖多孢菌中的同源性较低(表1)。因此本研究只在刺糖多孢菌中表达阿维链霉菌麦芽糖转运系统malEFg基因,以提高刺糖多孢菌对淀粉的利用能力。

2.2 pSET152::malEFg转化子的获得和验证
将阿维链霉菌麦芽糖转运系统表达载体pSET152::malEFg转化大肠杆菌ET12567,以其为供体菌通过接合转移转化刺糖多孢菌高产菌株ASAGF73,筛选具有安普霉素抗性的转化子。将转化子在抗性平板上转接5次以后,在TSB液体培养基中培养,收集菌丝体,提取基因组DNA。以转化子基因组为模板,PCR扩增安普霉素的抗性基因,同时以pSET152质粒为阳性参照。结果如图1所示,在转化子基因组中扩增出了安普抗性aprR基因(750bp)的特异性条带,说明重组菌株ASAGF73pSET152::malEFg构建成功。同时,其菌落形态和培养条件与出发菌株一致。

2.3 麦芽糖转运系统malEFg基因在刺糖多孢菌中的表达
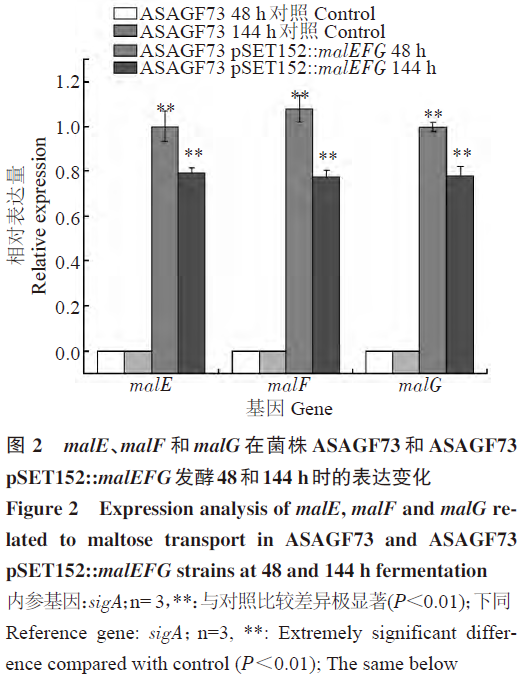
通过qRT-PCR对刺糖多孢菌重组菌ASAGF73 pSET152::malEFg在发酵48和144h时malE、malF和malg三个基因的表达变化情况进行检测,以ASAGF73菌株为阴性对照。结果表明,麦芽糖转运系统基因malE、malF和malg均已成功地在重组菌中表达(图2),且在发酵前后期表达量变化不大。由于malE、malF和malg三个基因位于一个转录子中,因此表达水平相当。
2.4 ASAGF73 及其重组菌ASAGF73 pSET152::malEFG的单一碳源发酵研究
分别将出发菌株ASAGF73及其pSET152::malEFg转化子进行以葡萄糖、麦芽糖和糊精为单一碳源的发酵实验。结果表明,含有malEFg表达载体的ASAGF73转化子与出发菌株相比生物量明显增加。发酵至144h时,在以糊精为单一碳源的培养基中,ASAGF73 pSET152::malEFg的生物量比出发菌株ASAGF73提高了21.4%(P<0.01),在以麦芽糖为单一碳源的培养基中生物量提高了26.7%(P<0.01);在葡萄糖为单一碳源时菌株间的差异不显著,且其生物量均低于以糊精或麦芽糖为碳源时的生物量(图3A)。ASAGF73在以糊精或麦芽糖为碳源时,发酵液中还原糖含量在发酵前后没有明显变化,而在葡萄糖为碳源的培养基中还原糖含量急剧下降,说明刺糖多孢菌ASAGF73对葡萄糖的利用率高,而对糊精和麦芽糖的利用率低。而在这三种不同碳源的培养基中,转化子ASAGF73 pSET152::malEFg的发酵液中还原糖含量均有显著下降的趋势,其中以糊精为碳源时还原糖浓度在发酵期间下降了56.8%(P<0.01),而以麦芽糖为碳源的培养基中还原糖浓度下降了48.1%(P<0.01)(图3B)。因此,阿维链霉菌malEFg基因的表达显著促进了刺糖多孢菌对糊精和麦芽糖的利用。在多杀菌素产量方面,以葡萄糖为唯一碳源时多杀菌素产量远高于以麦芽糖和糊精为碳源时的产量。重组菌株与出发菌株相比,在以葡萄糖和麦芽糖为碳源的培养基中菌株间的产量变化不显著,而在以糊精为主的培养基中转化子产量提高了17.8%(P<0.05)(图3C,出发菌株ASAGF73 144h时的产量设定为100%)。
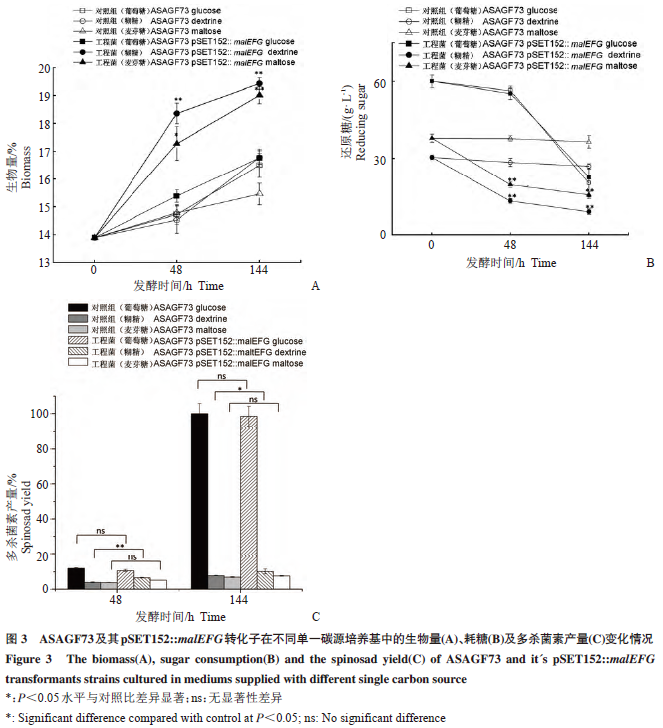
以上结果表明,在培养基含有糊精和麦芽糖时,阿维链霉菌malEFg基因的表达能够提高菌体对糊精和麦芽糖的利用能力,为菌体生长提供了更多的碳源,进而提高了菌体的生物量。
3 讨论
本实验室前期刺糖多孢菌发酵条件优化研究发现,刺糖多孢菌ASAGF73在发酵中、后期对速效碳源葡萄糖的利用能力比较突出,但在发酵前期对葡萄糖的利用能力低,且葡萄糖对菌体生长会有一定抑制作用(周纪,2015)。本研究中,当以葡萄糖为单一碳源时,ASAGF73在发酵前期(0~48h)对葡萄糖利用缓慢,与实验室前期研究结果相似(周纪,2015)。淀粉通常是工业化发酵的主要碳源,其成本低廉,来源丰富,作为一种缓释碳源可以克服葡萄糖代谢过快的弊病。但刺糖多孢菌利用淀粉和麦芽糖的能力很弱(王超,2009),这为工业发酵生产多杀菌素带来了很大的困难。在本研究中,高产菌株ASAGF73利用淀粉能力微弱,在以糊精和麦芽糖作为单一碳源时生物量和产量都比较低。目前关于刺糖多孢菌利用淀粉能力的研究鲜有报道。王超(2009)将刺糖多孢菌野生型ATCC49460和阿维链霉菌高产菌株UA-G进行双亲紫外灭活原生质体融合,选育能够利用淀粉产多杀菌素的菌株,获得的F17融合子可在以可溶性淀粉为唯一碳源的培养基中生长和合成多杀菌素。本研究在刺糖多孢菌中表达了阿维链霉菌中的麦芽糖转运系统,发现malEFg基因的表达能够明显提高刺糖多孢菌对糊精和麦芽糖的利用。在以糊精为单一碳源时,转化子的生物量相较于出发菌株有显著提高,并高于葡萄糖为单一碳源时的生物量,同时,多杀菌素的产量也有所提高。但是,在糊精为单一碳源的培养基中转化子的多杀菌素产量仍然较低,推测其原因可能是刺糖多孢菌对于麦芽糊精的水解能力较低,糊精糊化产生的这类糖通过麦芽糖转运系统进入细胞后主要参与细胞生长,而非参与多杀菌素合成;葡萄糖是多杀菌素合成的前体物质,其供应不足直接影响了多杀菌素的合成。因此,在本研究基础上,若能通过基因工程的方法提高刺糖多孢菌水解和利用多糖的能力,优化ASAGF73 pSET152::malEFg菌株发酵过程中的糊精和葡萄糖配比,对于推动刺糖多孢菌的工业化发酵生产多杀菌素有着实际应用价值。
4 结论
本研究在刺糖多孢菌高产菌株ASAGF73中表达了阿维链霉菌的麦芽糖转运系统相关基因malE⁃FG。结果表明,阿维链霉菌的麦芽糖转运系统能够帮助刺糖多孢菌提高对糊精和麦芽糖的利用,并促进菌体的生长。通过基因工程方法,进一步提高ASAGF73利用长效碳源的能力,将是提高多杀菌素产量的有效途径。本研究对利用淀粉为主要碳源发酵生产多杀菌素具有理论意义和应用价值。
| 相关附件 |


