降解玉米赤霉烯酮芽孢杆菌的筛选和鉴定
- 时间:2016-09-08
葛婵婵 熊犍 赵晨 申琳 张晓琳
玉米赤霉烯酮(Zearalenone,ZEN),又称F-2毒素,其化学名为6-(10-羟基-6-氧基-十一-碳烯基)β-雷锁酸内酯(图1),分子式为C18H22O5,分子量为318.36。ZEN是世界上污染最广泛的一种真菌毒素,能产生ZEN的镰刀菌包括禾谷镰刀菌(Fusariumgraminearum)、三线镰刀菌(Fusarium tricinctum)、黄色镰刀菌(Fusarium culmorum)、克鲁克威尔镰刀菌(Fusarium crookwellense)等,镰刀菌可侵染多种粮食作物,所以ZEN在小麦、大麦、玉米、燕麦、高粱、小米及大米中均有检出。

ZEN通过被污染的谷物、粮食以及肉奶等食品进入到人或者动物体内,可引发一系列的健康问题,如肝中毒、致畸、致癌等,并产生雌激素综合效应,包括外阴阴道炎、连续动情期、假孕、不育和子宫增大等。ZEN污染给人类带来了巨大的经济损失和健康威胁,越来越受到人们的关注。多年来,国内外人士一直致力于ZEN的脱毒研究,目前的主要方法有物理、化学和生物方法。化学法包括臭氧氧化、化学试剂处理等,物理法可通过热处理、水清洗、辐照、物质吸附等方法来清除ZEN。但是物理法和化学法在去除ZEN的同时,破坏谷物的营养成分、造成营养物质的流失,毒副作用较大,并且引发二次污染。目前关于微生物脱毒的途径可分为两种:微生物自身吸附和微生物降解。微生物真菌毒素生物降解法是指毒素分子的毒性基团被微生物的次级代谢产物或者所分泌的胞内、胞外酶分解破坏,同时产生无毒或低毒降解产物的过程,这种方法具有专一性强、转化效率高的特点。所以生物降解法是清除ZEN较为有效及可行的方法。目前,国内外已经分离出一些能够降解ZEN的菌株,如假单胞杆菌(Psedomonas otitidis)、植物乳杆菌(Lactobacillus plantarumfrom)。Krisztr等人发现链霉菌(Streptomyces)和红球菌(Rhodococcus)能够高效降解ZEN,且降解产物无毒。Tinyiro 等分离出两株芽孢杆菌能够将ZEN转化成无毒产物,且降解过程中有二氧化碳放出,降解酶为金属蛋白酶类。Yu等曾报道不动杆菌(Acinetobacter sp)SM04能够分泌一种过氧化物歧化酶,和ZEN的降解有关,并将这种酶的基因在大肠杆菌和酿酒酵母中成功表达。
本研究主要是以中国农业大学食品科学与营养工程学院985平台菌种保藏与应用中心分离、保藏的芽孢菌为研究材料,通过高通量筛选方法定向筛选可降解ZEN的芽孢杆菌,并探索其降解机理。
1 材料与方法
1.1 材料和试剂
菌株:400株芽孢杆菌均为中国农业大学食品科学与营养工程学院985平台菌种保藏与应用中心分离、保藏的菌株。
LB培养基:胰蛋白胨(Tryptone)10g,酵母提取物(Yeast extract)5g,NaCl 10g,ph7.0~7.2,121℃灭菌30min。
试剂:胰蛋白胨(Tryptone)、酵母提取物(Yeast extract)购自英国Oxoid公司;色谱纯乙腈、甲醇购自Dikma公司;ZEN标准品购自Sigma公司;引物27F、1495R购自英潍捷基公司。
1.2 仪器设备
高效液相色谱仪(Waters515/717/474):美国Waters公司;控温控湿摇床(ISF1-X):Adolf Kuhner公司;高速离心机(8510R)、PCR仪(22331):德国艾本德股份公司;高压细胞破碎仪(TS2/40/AA/AA):英国Constant Systems公司。
1.3 实验方法
1.3.1 ZEN降解菌株的筛选
ZEN降解菌株的初筛与复筛按照之前文献报道方法进行。
1.3.2 ZEN的检测
取待测样品,加入等体积的甲醇,充分混合后静置至少1h后,于14000r/min的条件下离心15min,取其上清液进行HPLC检测。
检测条件:安捷伦C18柱(5.0μm,150mm×4.6mm);流动相,乙腈∶水∶甲醇=46∶46∶8;流速:1.0mL/min;进样量:10μL;检测波长:激发波长274nm,发射波长440nm。
ZEN降解率/%=(空白对照组ZEN含量-样品组ZEN含量)/空白对照组ZEN含量×100。
1.3.3 ZEN降解菌株的16Sr DNA基因序列分析
将菌株于LB液体培养基中培养12h后,按照Promega公司的基因组DNA纯化试剂盒操作说明提取基因组DNA并作为16Sr DNA片段扩增模板。PCR扩增条件及16Sr DNA序列分析按照文献报道方法进行。系统发育进化树使用Mega6.0生物信息学分析软件完成。
1.3.4 菌株ZEN降解能力与活菌数的相关性
菌株与ZEN共培养,初始菌浓度为OD600=0.05,设置3个重复。通过在不同的培养时间(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、12.0h)取样进行HPLC检测,同时取样涂平板检测活菌数,分析ZEN(15μg/mL)降解率和培养时间及活菌数的关系。
1.3.5 菌株吸附与降解ZEN的活性验证
将培养至稳定期的菌液等体积分为两份,一份于121℃高压灭菌15min的条件下进行灭活处理;另一份暂不作任何处理。将上述两份细胞培养物在4000r/min下离心10min,用等量无菌水清洗菌体3次,将菌体用含10μg/mL ZEN的等量无菌水悬浮。以含ZEN的无菌水为空白对照,37℃、250r/min振荡培养72.0h,取样,离心取上清液,检测上清液中ZEN的残留量。离心后的菌体用甲醇浸提检测菌体对ZEN的吸附量。
1.3.6 菌株中ZEN降解酶的定性、定位
(1)取培养好的菌液,4000r/min、4℃离心20min,上层清液过0.22μm的水系滤膜,获得无细胞上清液,4℃保存备用,下层细胞用Tris-HCl重新悬浮,4000r/min、4℃离心15min,重复3次,冲洗3次后用Tris-HCl重新悬浮。将重新悬浮的细胞于4℃下用高压细胞破碎仪破碎3次。破碎后的细胞12000r/min、4℃离心15min,上层清液过0.22μm的水系滤膜,即为细胞内容物。将过完膜后的细胞内容物和原保留无细胞上清液分别分为两部分:未经处理和经过蛋白酶K(65℃水浴2h)处理的无细胞上清液和细胞内容物;将处理好和未经处理过的无细胞上清液及细胞内容物和ZEN(10μg/mL)共培养,每个样品做3个重复,培养48h后取样进行液相检测。
(2)根据1.3.6(1)中的结果,确定是无细胞上清液对ZEN具有降解作用还是细胞内容物对ZEN具有降解作用。将具有降解作用的无细胞上清液或细胞内容物用millipore超滤浓缩管(3K)浓缩100倍,进行非变性聚丙烯酰胺凝胶电泳,并根据蛋白条带切胶回收蛋白,回收的蛋白与10μg/mL的ZEN共培养,48h后取样,HPLC测定ZEN的含量。
2 结果与分析
2.1 ZEN降解菌株的筛选
将已有的400株芽孢杆菌按照1.3.1中的方法,在LB培养基中与ZEN共培养,并按照1.3.2中的方法检测,当菌株与ZEN(10μg/mL)共培养72h时,发现若干株菌菌液中ZEN峰(7.25min)完全消失,说明这些菌株对ZEN的清除率达到100%,根据液相色谱图可以将这些芽孢杆菌分为两种类型:一种是以373-2为代表,与对照组相比,共培养物中只有杂质峰,没有新物质峰产生(图2a2),另一种是以菌株411-1为代表,与对照组相比,液相色谱图中除了杂质峰(1.53min),还有新物质峰(2.51min)产生(图2b2)。液相色谱图说明这两株菌可能通过两种不同的途径清除ZEN。

2.2 ZEN降解菌株的16Sr DNA序列分析
将获得的序列通过Clone Manager 8进行分析处理,去掉质粒序列,获得16Sr DNA序列。将373-2和411-1的测序结果在NCBI上经过BLAST比对分析,结果显示菌株373-2和411-1分别与死谷芽孢杆菌(Bacillus vallismortis)和枯草芽孢杆菌(Bacillus subtilis)的16Sr DNA序列的相似性最高,达到99%。从系统进化树分析结果(图3)可以看出,373-2与死谷芽孢杆菌(Bacillus vallismortis)并不处在同一分支,很有可能为一新种;411-1与枯草芽孢杆菌(Bacillus subtilis)在同一分支上,该比对结果与gyrB基因序列比对结果相同,因此411-1为枯草芽孢杆菌。

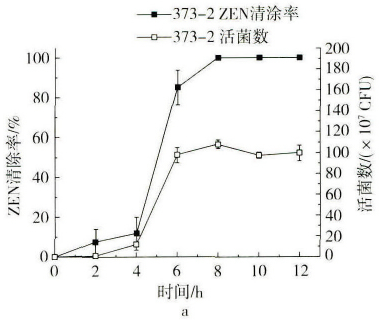
2.3 菌株ZEN降解能力与活菌数的相关性
在相同的初始菌体浓度下,菌株373-2和411-1分别能在8h和6h内将15μg/mL的ZEN完全清除(图4)。两株菌株在0~2h内表现出不同的清除能力,在2h时,二者的ZEN清除率分别达到7.49%和32.16%,相对应的活菌数分别为0.89×107CFU和1.59×107CFU。在2~6h内,菌株373-2和411-1的ZEN清除速率都有较大幅度的增加,分别上升至85.15%和100%;6h时,菌株373-2和411-1的相应活菌数分别为97.66×107CFU和163.66×107CFU,在稳定期的活菌数分别约为100×107CFU和170×107CFU。由此可见菌株411-1对ZEN的清除能力要优于菌株373-2,可能是由于同一条件下相同培养时间内菌株411-1的活菌数都要高于菌株373-2。在前期研究中我们已经发现,芽孢菌对ZEN的清除可能同时包含吸附和降解作用。结合菌株373-2和411-1的生长曲线和降解曲线可知,菌株在0~2h时之所以对ZEN降解速率较低,可能是由于菌株处在延滞期,细胞数量少,吸附作用和相关毒素降解酶产量较低;而在3~6h时菌株进入对数生长期,且细胞代谢能力强,因此吸附效果和酶合成能力加强,使降解速率提高。

2.4 菌株对ZEN吸附与降解活性验证
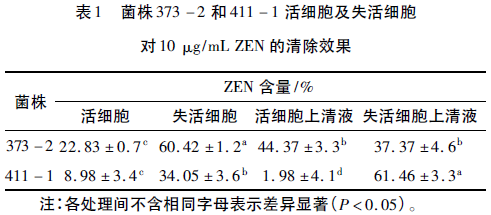
将菌株373-2和411-1的活细胞及失活细胞与ZEN共培养,检测ZEN在共培养物上清液及菌体细胞中的含量,判断对ZEN的清除作用是吸附还是降解。在共培养一段时间后,发现菌株373-2和411-1的活细胞和失活细胞中都含有ZEN,表明373-2和411-1对ZEN都具有吸附作用(表1)。且菌株373-2和411-1的失活细胞对ZEN的吸附能力都显著高于活细胞对ZEN的吸附能力(P<0.05),这可能是由于热处理使细胞壁多聚糖和肽聚糖的糖苷键或者肽键断裂,使肽聚糖结构变薄而孔径增大,细胞对真菌毒素的吸附能力增加。活细胞中和活细胞上清液中ZEN的含量表明:菌株373-2对ZEN的吸附能力强于411-1,且经过处理的两株菌的活细胞除了对ZEN具有吸附作用外还可能存在降解作用,菌株411-1对ZEN的降解活性要强于373-2。
2.5 ZEN降解酶的定性和定位
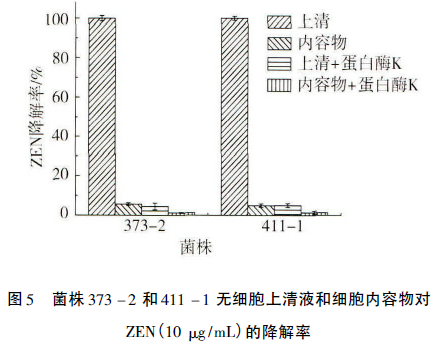
菌株373-2和411-1的无细胞上清液和细胞内容物与ZEN共培养48h,10μg/mL的ZEN可被两株菌的无细胞上清液完全清除(图5),而细胞内容物对ZEN也有少量清除,可能与未完全破碎细胞对毒素的吸附有关。但经蛋白酶K处理过的373-2和411-1的无细胞上清液和细胞内容物在与ZEN共培养48h后,无细胞上清液和细胞内容物对ZEN几乎没有降解效果,尤其是上清液,基本丧失了ZEN的清除活性。由此可见,清除ZEN的373-2和411-1的胞外活性物质能够被蛋白酶K水解而失活。因此推断该活性物质可能是这两株菌分泌的胞外酶。
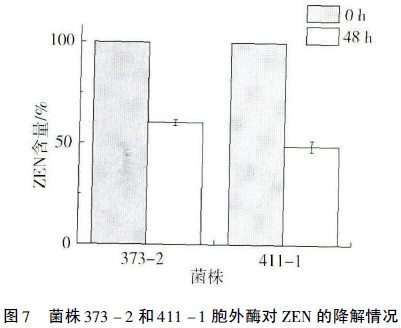
对两株菌的无细胞上清液浓缩后,进行非变性丙烯酰胺凝胶电泳。菌株373-2和411-1胞外蛋白组成明显不同,如图6所示,373-2胞外蛋白条带数目明显少于411-1胞外蛋白条带数目。分别对373-2和411-1的胞外蛋白进行回收,并将回收的蛋白和10μg/mL的ZEN共培养,48h后取样测定ZEN的含量,结果显示(图7):菌株373-2和411-1的胞外蛋白和ZEN共培养48h后,ZEN的含量分别减少至60.07%和49.72%。因此进一步确定,373-2和411-1清除ZEN的活性物质源自于这两株菌分泌的一种或几种胞外酶。

3 结论
本研究主要通过菌株与毒素共培养的方法,筛选出一株新种芽孢杆菌373-2及一株枯草芽孢杆菌411-1,它们分别能在8h内和6h内将15μg/mL的ZEN完全降解。液相结果显示两株菌对ZEN的降解作用可能通过两种不同的途径。对降解机理的研究表明,菌株可以通过细胞的吸附和酶活作用共同清除ZEN,其中降解起到主要作用。
通过生物降解减少真菌毒素危害是近年来研究的热点,本研究中所获得的ZEN降解菌株可为该领域研究提供新的研究素材。在本研究基础上,我们将进一步对降解酶进行分离纯化及降解产物结构的鉴定,为ZEN生物脱毒的研究提供新的理论基础。
| 相关附件 |


