降解玉米赤霉烯酮的芽孢杆菌筛选
- 时间:2016-09-08
葛婵婵 熊犍 赵晨 汪洋 申琳 张晓琳
玉米赤霉烯酮(Zearalenone,ZEN)又称F-2毒素,是镰刀菌产生的雌激素类真菌毒素。ZEN最初从感染赤霉病的玉米中分离得到,可引起谷物及其加工产品的污染。ZEN主要由禾谷镰刀菌(Fusarium graminearum)产生,此外,三线镰刀菌(Fusarium tricinctum)、黄色镰刀菌(Fusarium culmorum)、克鲁克威尔镰刀菌(Fusarium crookwellense)等多种镰刀菌也会产生ZEN。
据统计,全世界约有25%的谷物受到真菌的污染,且ZEN在全世界的谷物和农产品中均有检出。熊凯华曾对采集的玉米和小麦样品进行分析,结果表明:玉米和小麦样品中ZEN的检出率分别为78.6%和69.3%。真菌毒素污染的谷物被人或家畜摄入,会引起慢性或者急性疾病。有报道称ZEN能够影响家畜的繁殖性能,人经常误食含ZEN的食物能引发乳腺癌、造成DNA损伤、诱导染色体失常等。ZEN污染不仅造成经济上的损失,更是严重威胁机体健康,因此,如何解决ZEN对粮食和饲料的污染,对改善动物生产性能、提高人类食品安全有非常重要的意义。目前对ZEN的脱毒研究主要有物理、化学和生物方法。物理和化学脱毒不能彻底去除ZEN的毒性,还会造成营养物质的流失,同时存在一些未知的二次污染。生物脱毒则是微生物通过生物代谢将ZEN降解成为一些低毒或者无毒的物质,是一种更为高效、安全的方法。
目前,国内外关于ZEN生物降解的研究已有诸多报道,具有ZEN降解能力的菌株不仅种类多样,降解能力也有所差异。Krisztr等人对具有ZEN降解能力的链霉菌(Streptomyces)、假单胞菌(Pseudomonas)、红球菌(Rhodococcus)和戈登氏菌(Gordonia)的降解能力和降解产物进行比较,发现链霉菌(Streptomyces)和红球菌(Rhodococcus)能够高效降解ZEN,且其降解产物无毒。K.J.Cho等分离出一株芽孢杆菌(Bacillus),在液体培养基中对1mg/kg的ZEN降解率达到99%,在固态发酵中对0.25mg/kg的ZEN降解率达95%。另外,有研究表明一些微生物对ZEN的清除作用来自菌体本身的吸附,El-Nezamih等发现鼠李糖乳杆菌(Lactobacillus rhamnosusstrain)Gg和LC750对ZEN及其衍生物的清除作用并不是微生物降解而是细胞壁的吸附,且这种吸附作用和细胞的浓度有关。有文献报道,一些根霉菌(Rhizopus)和粉红粘帚菌(Gliocladium roseum)对ZEN也具有降解作用。
本研究主要是以中国农业大学食品科学与营养工程学院985平台菌种保藏与应用中心分离、保藏的217株芽孢菌为研究材料,通过菌株和毒素共培养的方法,筛选能够高效降解ZEN的菌株,并对其降解机理做初步研究,为谷物中真菌毒素的污染控制提供新的菌种资源。
1材料和方法
1.1材料和试剂
菌株:217株芽孢菌均为中国农业大学食品科学与营养工程学院985平台菌种保藏与应用中心分离、保藏的菌株。
LB培养基:胰蛋白胨10g,酵母提取物5g,NaCl 10g,pH 7.0~7.2,121℃灭菌30min。主要试剂:胰蛋白胨、酵母提取物购自英国Oxoid公司;色谱纯乙腈、甲醇购自Dikma公司;ZEN标准品购自Sigma公司;引物27F、1495R购自英潍捷基公司。
1.2 仪器设备
高效液相色谱仪(Waters515/717/474):美国Waters公司;控温控湿摇床(ISF1-X):Adolf Kuhner公司;高速离心机(8510R):德国艾本德股份公司;PCR仪(22331):德国艾本德股份公司;高压细胞破碎仪(TS2/40/AA/AA):英国Constant Systems公司。
1.3 实验方法
1.3.1 ZEN降解菌株的筛选
(1)ZEN降解菌株的初筛:将217株芽孢杆菌分别接种到LB液体培养基中,于37℃、250r/min条件下进行活化。12h后,将新鲜种子液接种到含有ZEN(10μg/mL)的LB液体培养基中,使接种后培养基的OD600值为0.05(用未接种的LB液体培养基做空白对照),以96孔板作为培养载体,于37.0℃、250r/min、85%RH条件下进行脱毒培养。72h后,取样以备HPLC检测残余毒素含量,同时以未接种并含有相同ZEN浓度的LB培养基为对照。
(2)ZEN降解菌株复筛:将ZEN的浓度增加到15μg/mL,按照(1)中的方法对初筛得到的菌株进行复筛。每种菌株做3个平行。
1.3.2 ZEN的检测
取待测样品,加入等体积的甲醇,混合后静置1h,充分浸提。然后于14000r/min的条件下离心15min,取其上清进行HPLC检测。对照做同样处理。
检测条件:安捷伦C18柱(5.0μm,150×4.6mm);流动相,乙腈∶水∶甲醇=46∶46∶8;流速,1.0mL/min;进样量,10μL;检测波长,激发波长274nm,发射波长440nm;ZEN标准曲线为y=2576.61+41347.74x,R2=0.9985,x为ZEN浓度(μg/mL),y为峰面积(mv·s),标准曲线在1.0~50.0μg/mL浓度范围内线性关系良好。
ZEN降解率=(空白对照组ZEN含量-样品组ZEN含量)/空白对照组ZEN含量×100%。
1.3.3 ZEN降解菌株的16Sr DNA序列分析
将ZEN降解率较高的菌株于LB液体培养基中培养12h后,按照Promega公司的基因组DNA纯化试剂盒操作说明书提取基因组DNA,提取的DNA作为16Sr DNA片段扩增模板。扩增引物为:27F(5’-GAGAGTTTGATCCTGGCTCAG-3’),1495R(5’-CTACGGCTACCTTGTTACGA-3’)。PCR反应条件:变性(95℃,30s),退火(55℃,30s),延伸(72℃,2min),30个循环。PCR扩增片段经纯化、转化、酶切验证等一系列常规分子生物学操作,获得阳性转化子,送样至英潍捷基(Invitrogen)公司进行测序。阳性转化子测序结果经拼接处理后在NCBI上使用Blast比对,获知降解菌株的分类地位。
1.3.4 降解菌株生长曲线及其ZEN降解曲线的绘制
芽孢杆菌生长曲线的绘制:将活化的菌株接种到液体培养基中,使接种后的培养基OD值为0.05(用未接种的LB液体培养基做空白对照),于37℃、250r/min振荡培养,每隔1h取样,选用600nm波长进行光电比浊测定。对细胞密度大的培养液适当稀释后测定。取降解率较高的菌株,按照1.3.1(1)中的方法,每个样品做3个重复,通过在不同的培养时间(1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、12.0、24.0h)取样进行HPLC检测,研究ZEN(15μg/mL)降解率和培养时间的关系。
1.3.5 降解菌株对ZEN吸附情况的研究
将培养至稳定期的LB液体培养物进行等分,一份于121℃高压灭菌15min的条件下进行灭活处理;另一份暂不作任何处理。然后,将上述两份细胞培养物做如下处理:4000r/min,离心10min,弃上清后,用等量PBS清洗菌体3次后加入无菌水清洗菌体3次,后用含ZEN(15μg/mL)的等量无菌水悬浮菌体。以含ZEN的无菌水为空白对照,37℃、250r/min振荡培养72.0h,取样,14000r/min离心10min,取上清,进行液相检测。每个样品做3个重复。
1.3.6 ZEN降解酶的定位实验
(1)取培养好的菌液,4500r/min、4℃离心20min,上清过0.22μm的水系滤膜,4℃保存备用,下层细胞用Tris-HCl重新悬浮,4000r/min、4℃离心15min,重复3次,冲洗3次后用Tris-HCl重新悬浮。将重新悬浮的细胞于4℃下用高压细胞破碎仪破碎3次。破碎后的细胞12000r/min、4℃离心15min,上层清液过0.22μm的水系滤膜。在过完膜后的细胞内容物和原保留无细胞上清中加入一定量的ZEN(终浓度为10μg/mL),于30℃、20r/min下共培养48h,细胞内容物和无细胞上清分别作为阴性参照,Tris-HCl+ZEN和LB培养基+ZEN为阳性参照。于不同时间取样,进行HPLC检测。
(2)根据1.3.6(1)中的结果,确定是无细胞上清对ZEN具有降解作用还是细胞内容物对ZEN具有降解作用。将具有降解作用的无细胞上清或者细胞内容物分为三个部分进行不同处理:1.用蛋白酶K处理无细胞上清或者细胞内容物(65℃水浴2h);2.沸水浴处理无细胞上清或者细胞内容物(100℃,2h);3.同时用蛋白酶K和沸水浴处理无细胞上清或者细胞内容物(65℃处理2h后,100℃处理2h)。将处理好的无细胞上清或者细胞内容和ZEN(10μg/mL)共培养,没有处理的无细胞上清或者细胞内容物作为对照,每个样品做3个重复,培养48h后取样进行液相检测。
2 结果与分析
2.1 ZEN降解菌株的筛选
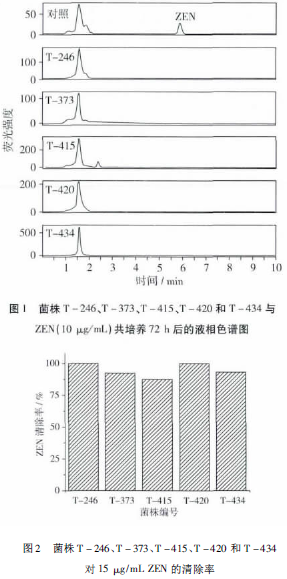
将已有的217株芽孢杆菌按照1.3.1(1)中的方法,在LB培养基中与ZEN共培养,并按照1.3.2中的方法检测,液相色谱图显示(图1):ZEN峰保留时间为5.87min,且当菌株与ZEN(10μg/mL)共培养72h时,217株芽孢杆菌中有5株芽孢菌(T-246、T-373、T-415、T-420、T-434)ZEN峰完全消失,说明这5株菌对ZEN的清除率达到100%。将初筛得到的5株菌株进行复筛,结果如图2所示,当ZEN的含量为15μg/mL时,这5株菌对ZEN的降解率都达到85%以上,ZEN降解率的相对标准偏差都在3.3%以下,重复性良好。其中菌株T-246和T-420对ZEN的降解效果最好,在72h内能够将15μg/mL的ZEN完全清除。
2.2 ZEN降解菌株的16Sr DNA序列分析
使用Clone Manager 8对获得的测序结果进行分析处理,去掉重叠区域,质粒序列,得到16Sr DNA部分序列。T-246和T-420序列长度分别为1588bp和1598bp。将测序结果在NCBI上经过BLAST比对分析,结果显示菌株T-246和T-420分别和同温层芽孢杆菌(Bacillus stratosphericus)及短小芽孢杆菌(Bacillus pumilus)的16Sr DNA序列的相似性最高,达到99%。目前普遍认为当16Sr DNA序列同源性高于97%时,可以认为是属内的同种,依据这一原则将T-246与T-420分别暂定为同温层芽孢杆菌和短小芽孢杆菌。
2.3 降解菌株生长曲线及其ZEN降解曲线的绘制
图3为菌株T-246和T-420的生长曲线,在LB培养基中于37℃、250r/min条件下培养,菌株T-246和T-420都为芽孢杆菌,且生长曲线比较一致,2~13h为对数期,13h后进入稳定期。

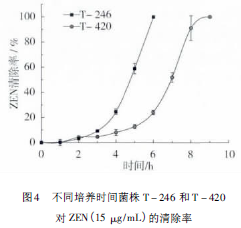
由图4可以看出,在相同的初始菌体浓度下,菌株T-246和T-420分别能在6h和9h内将15μg/mL的ZEN完全降解。两株菌株均在0~3h时开始表现出一定的降解能力,在3h时,二者的ZEN降解率分别达到9.4%和4.7%。但在3~6h内,T-246的ZEN降解速率有较大幅度的增加,由9.4%上升至100%;菌株T-420在此时间段的ZEN降解速率也有所增加,由4.7%上升至24.1%,但增幅不及T-246,菌株T-420在6~9h降解速率最大,从24.1%上升至100%,由此可见菌株T-246对ZEN的降解能力要优于菌株T-420。结合菌株T-246和T-420的生长曲线可知,两株菌在0~3h时之所以对ZEN降解速率较低,可能是由于菌株处在延滞期,细胞数量少,且相关毒素降解酶活力较低;而在3~9h时菌株进入对数期,细胞代谢能力强,酶系活力高,降解速率较高。
2.4 降解菌株对ZEN吸附情况的研究
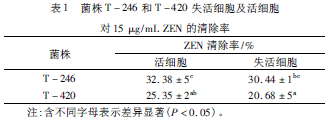
通过研究T-246和T-420的活细胞及失活细胞对ZEN的清除率,发现:高温失活的T-246和T-420细胞对ZEN都具有清除作用,失活细胞排除了生物活性物质降解ZEN的可能性,表明T-246和T-420对ZEN都具有吸附作用(表1)。同时,T-246和T-420的活细胞对ZEN的清除能力都高于失活细胞,但差异并不显著(P>0.05),这可能是由于经过处理后的活细胞不仅对ZEN具有吸附作用,而且产生了能够降解ZEN的活性物质,而经高温失活的细胞对ZEN只有吸附作用,所以活细胞对ZEN的清除能力高于失活细胞;然而,由于用无菌水和PBS清洗后的活细胞,缺乏营养物质,细胞活力及代谢能力不高,所以活细胞对ZEN的清除能力虽高于失活细胞,但是并不显著。另外,T-246的活细胞和失活细胞对ZEN的清除能力显著高于菌株T-420的活细胞和失活细胞(P<0.05),且四者清除率都在20%~33%之间。
2.5 ZEN降解酶的定位
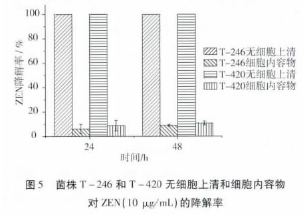
(1)如图5所示,菌株T-246和T-420的无细胞上清和细胞内容物与ZEN共培养48h,于24h时取样检测发现两种菌株的无细胞上清能够将10μg/mL的ZEN完全降解,而细胞内容物对ZEN的降解率还不到10%,48h后,细胞内容物对ZEN的降解率也没有明显的增加。结果表明:菌株T-246和T-420之所以能够降解ZEN,是由于这两株菌的胞外活性物质对ZEN具有降解作用。
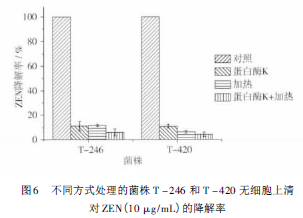
(2)上述验证了两株菌对ZEN起降解作用的主要是无细胞上清,对两株菌的无细胞上清分别用蛋白酶K、加热或蛋白酶K和加热共同处理,结果见图6。与ZEN共培养48h后,菌株T-246和T-420的无细胞上清能够将10μg/mL的ZEN完全降解,然而经过蛋白酶K、加热或蛋白酶K和加热共同处理,严重影响到无细胞上清对ZEN的降解率,由此可见,降解ZEN的T-246和T-420的胞外活性物质能够被蛋白酶K水解,并且高温会使其变性失去活性。因此推断,T-246和T-420之所以能够降解ZEN源自于这两株菌分泌的一种或几种胞外酶能使ZEN降解。
3 结论
本研究主要通过菌株与毒素共培养的方法,筛选出一株同温层芽孢杆菌(Bacillus stratosphericus)T-246和一株短小芽孢杆菌(Bacillus pumilus)T-420,它们分别能在6h内和9h内将15μg/mL的ZEN完全降解。对其毒素清除机理的初步研究表明,这两株菌可以通过菌体细胞的吸附和酶活作用共同清除ZEN。Tinyiro S E等曾筛选出一株枯草芽孢杆菌(Bacillus subtilis 168)和一株纳豆芽孢杆菌(Bacillus natto CICC 24640),对ZEN(20μg/L)的降解率分别为95%和78%。之后研究发现这两株菌菌体和代谢产物对ZEN存在不同程度的吸附和降解作用,所得结果与本实验结果相似,但从对ZEN的清除能力来看,本实验中筛出的菌株T-246和T-420对ZEN的清除能力要优于上述的枯草芽孢杆菌(Bacillus subtilis 168)和纳豆芽孢杆菌(Bacillus natto CICC 24640)。
本研究获得的两株芽孢杆菌具有高效降解ZEN的能力,为今后的机理和应用研究提供实验材料。后续研究中,我们将进一步从分子水平阐述其降解机制,为ZEN生物脱毒的研究提供新的理论,同时在应用研究方面,拟对菌株的固态发酵的实际脱毒效果进行测评,并开发出相关的微生物脱毒剂,为ZEN含量超标的谷物无害化处理提供新的思路和技术策略。
| 相关附件 |


