多杀菌素高产菌株快速筛选方法的研究
- 时间:2016-09-08
陈园 熊犍 王超 Eddie Chio 邹球龙 张晓琳
多杀菌素(spinosad)是由土壤放线菌刺糖多孢菌(Saccharopolyspora spinosa)经好氧发酵产生的胞内次级代谢产物,是一种具有触杀及摄食毒性的广谱杀虫剂,选择性高,对鞘翅目、双翅目、同翅目、膜翅目、鳞翅目、缨翅目等多种昆虫和田间害虫均有良好的防治效果。兼具生物农药安全性和化学农药速效性的多杀菌素有望成为我国生物农药产业一个新的经济增长点。然而,多杀菌素的培养周期长,利用传统的突变株单菌落发酵,HPLC检测确定高产菌株耗时较长,因此建立一种多杀菌素高产菌株快速筛选模型,对于缩短多杀菌素高产菌株筛选周期,提高筛选效率有着重要意义。
化合物的杀虫活性筛选,是利用昆虫对供试化合物的反应来判断或鉴别其是否具有生物活性及生物活性大小。从20世纪50年代相继应用以来,以小型生物作为靶标动物的活体筛选模型,在筛选杀虫活性物质方面取得了很大成就,以卤虫作为活体筛选模型获得新型杀虫农用抗生素Diox pyrrolomycin,同时该方法也应用在医用植物、微生物的活性筛选中。美国礼来公司研发人员曾采用昆虫筛选模式,在1年的时间内筛选到了多杀菌素高产菌株S.sponosa A83543。本研究在96孔板高通量培养体系的基础上,利用生测试虫的致死率与多杀菌素浓度的相关性,建立多杀菌素高产菌株快速筛选模型。
1 材料与方法
1.1 菌株、供试虫源及培养基
1.1.1 菌株
刺糖多孢菌ASAGF73由国家粮食局科学研究院发酵生物技术实验室筛选和保藏。
1.1.2 供试虫源
埃及伊蚊(aedes aegypti)和白纹伊蚊(aedes albopictus)虫卵由中国疾病预防控制中心提供。
1.1.3 培养基
固体培养基(g/L):葡糖糖5.0,牛肉膏3.0,酪蛋白胨0.25,琼脂18.0,pH 7.2。
种子培养基(g/L):葡萄糖10.0,大豆蛋白胨30.0,酵母提取物3.0,MgSO4 2.0,pH 7.2。
发酵培养基(g/L):葡萄糖50.0,棉籽蛋白20.0,NaCl 3.0,K2HPO4·3H2O 0.2,FeSO4·7H2O 0.05,CaCO3 5.0,pH 7.2。
上述培养基均在115℃灭菌25min。
1.2 主要试剂与仪器设备
CH3CN和CH3OH:色谱纯,德国Merck公司;spinosad标准品:纯度为98%,美国Sigma公司;Na2S2O3、丙酮:分析纯,国药。
全自动移液工作站epMotion 5070、Eppendorf AG 22331 Hamburg型离心机、德国Eppendorf公司;ISF12X恒温恒湿摇床:瑞士阿道夫科耐公司;HPS-400生化培养箱:哈尔滨市东联电子技术开发有限公司;Waters 515/2487型高效液相色谱仪:美国Waters公司;96孔细胞培养板:美国BD公司;KH-50B超声波清洗器:昆山禾创超声仪器有限公司。
1.3 方法
1.3.1 蚊子幼虫饲养
将虫卵置于加入饲料的水盆中,在30℃,湿度85%的条件下培养2~5d。根据蚊子生长情况获得实验所需1龄、2龄和3龄幼虫。
1.3.2 多杀菌素标品的制备
配制200、100、50、25、12、6、3、1.5、1μg/mL和0.5μg/mL浓度多杀菌素标品,置于96孔板中,每剂量设置8个重复。
1.3.3 生测实验
发酵液中加入甲醇浸提多杀菌素,4000r/min离心20min,取100μL上清液加入96孔板中,设置8个重复,低温避光下挥干有机溶剂后每孔加入100μL去离子水复溶多杀菌素,再加入适龄蚊子幼虫,每孔控制数量5~8只,每隔1h观察一次,记录蚊子幼虫死亡情况。
1.3.4 HPLC检测
取一定体积发酵液,加入2倍体积的甲醇,充分振荡混匀后,静置30min,4000r/min离心20min,取上清液进行HPLC分析,分析条件为: C18反相柱(ZORBAX Ecllipe XDB-C18,4.6mm×100mm,3.5μm);流动相为乙腈∶甲醇∶水(45∶45∶10,含0.05%乙酸铵,v∶v);进样量为10μL;流速为1.0mL/min;检测波长为244nm。根据多杀菌素A和D组分的积分面积,参照标准品计算其质量浓度,两组分之和为多杀菌素发酵产量。
1.4 数据处理
采用Origin 8.0和SPSS 16.0 for windows软件进行数据统计学处理和分析。计算公式为:

其中,P—校正死亡率,p—未校正死亡率,c—对照组死亡率。
2 结果与分析
2.1 超声时间对多杀菌素复溶率的影响
选取20、80、160、200、300μg/mL的多杀菌素发酵液离心后得上层清液,设置3个重复,低温避光挥干后加入100μL去离子水,分别超声2,5、7min进行复溶,HPLC检测其多杀菌素浓度,计算溶出率,结果如图1所示。

从图1中可以看出,多杀菌素发酵液经不同时间超声后,溶出率均保持在一定范围。超声时间越长,其溶出率越高,但是其偏差也越大。这可能由于长时间超声使部分孔内液体溅出,导致样品间平行性较差。超声2min和5min得到的溶出率值接近,且偏差较小,因此,确定超声2min作为最佳条件。
2.2 生物检测方法的空白对照
根据实验操作步骤和条件设置空白对照,分别设置8个重复的甲醇、发酵液及甲醇浸提发酵液在96孔板中,每孔加入5~8只幼虫,静置观察,24h后观察幼虫生长良好,均对幼虫无影响。因此,实验操作过程和环境条件对幼虫无致死效应。
2.3 不同种类蚊子幼虫的敏感性
选取埃及伊蚊和白纹伊蚊2龄幼虫作为供试虫源,每种幼虫在200μg/mL多杀菌素浓度下设置8个重复,统计不同时间的致死率,结果如表1所示。
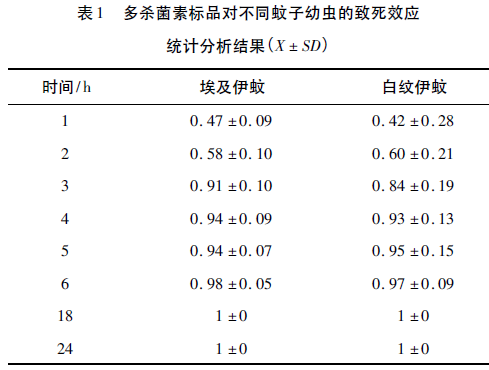
由表1可知,在同一多杀菌素浓度下,伊蚊幼虫的死亡率与作用时间相关,随着时间的延长,伊蚊幼虫的死亡率逐渐增高;两种伊蚊幼虫在同一时间的死亡率基本相同,但白纹伊蚊的偏差较大。因此选用埃及伊蚊作为供试虫源用于高通量快速筛选模型的建立。
2.4 不同虫龄幼虫的敏感性
选取1龄、2龄、3龄幼虫进行幼虫敏感性实验,并对多杀菌素在不同时间段的生测实验数据进行统计学分析,结果如表2~表4所示。
由表2~表4中统计分析结果可知,不同虫龄的蚊子幼虫对多杀菌素的敏感度不同(以幼虫不能正常游动,包括幼体微弱蠕动和无任何反应作为死亡记录标准)。处理时间为1h时,50μg/mL多杀菌素对应的死亡率,1龄幼虫开始有死亡,2龄、3龄幼虫均无死亡情况;6h时,1龄幼虫全部致死,2龄和3龄均有活体幼虫,实验结果表明,埃及伊蚊1龄幼虫对多杀菌素非常敏感;并且1龄幼虫个体小,不利于观察和计数,相同时间内,浓度检测线过低,不利于建立快速筛选模型。
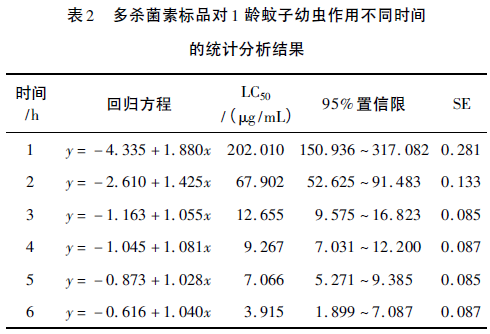
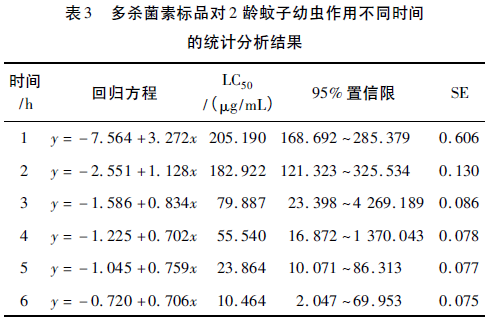
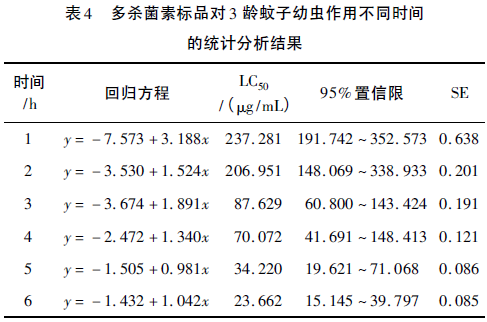
不同处理时间的研究结果发现,3龄幼虫的LC50均大于2龄幼虫,说明3龄幼虫对多杀菌素的敏感性较2龄幼虫低;从毒力回归方程标准误差SE中可以看出,每一时间段内,3龄幼虫的标准误差均高于2龄幼虫;同时,3龄幼虫体型粗壮,实验过程中容易受机械损伤而导致结果误差偏大;综合考虑2龄蚊子幼虫最适用于多杀菌素高产菌株快速筛选模型。
2.5 生测初筛模型的可行性验证
采用多杀菌素发酵液对埃及伊蚊2龄幼虫进行生物检测,统计多杀菌素产量对幼虫的致死率,并对相应的发酵液进行HPLC检测其多杀菌素产量,1h时统计的部分结果见图2。2h时,发酵产量20μg/mL以上时,蚊子幼虫致死率达到100%,不利于后期的复筛验证。

从图2可以看出,发酵液对蚊子幼虫的致死率在一定范围内与多杀菌素浓度呈正相关。发酵产量在15μg/mL以下时,致死率维持在20%以下;在20~35μg/mL之间时,致死率随着多杀菌素发酵产量的增加而增加。在发酵液对生测作为初筛模型的可行性验证过程中发现,相同时间内,发酵液的致死率要高于标品,分析其原因可能是96孔板对发酵液中多杀菌素外的物质有一定的吸附,导致发酵液中多杀菌素的溶出率要高于标准品。
3 结论
本文完善了基于96孔板的多杀菌素高产菌株高通量筛选方法,验证了生测作为初筛进行多杀菌素高产菌株的高通量筛选方法的可行性。结果表明,多杀菌素浓度与蚊子幼虫的死亡率呈良好的线性关系,即多杀菌素浓度与幼虫的死亡率呈正相关。在诱变筛选的过程中,相同时间内,选择致死率高的突变株进行复筛验证。经过大量验证实验,确定选择1h内致死率达到90%以上的菌株进行复筛。
本文研究发现利用2龄埃及伊蚊幼虫可以建立快速初筛模型,生测曲线拟合获得的毒力回归方程标准误差较小,说明利用2龄埃及伊蚊幼虫建立快速初筛方法可行。
与其他方法相比,该方法操作简单方便,节省了大量试剂和实验室空间,缩短了菌株筛选周期,避免大批量筛菌带来的测发酵产量的耗时困境,是快速高效、低成本筛选高产菌株的模型。
| 相关附件 |


