多杀菌素产生菌的高通量诱变选育
- 时间:2016-09-08
陈园 熊犍 郭伟群 刘国丽 邹球龙 张晓琳
多杀菌素(spinosad)是由土壤放线菌刺糖多孢菌(Saccharopolyspora spinosa)经好氧发酵产生的胞内次级代谢产物,它是一种具有触杀及摄食毒性的新型微生物源杀虫剂。多杀菌素具有作用方式独特、选择性高、对非靶标动物安全以及降解产物安全等优异特性,使其成为历史上唯一三次获得美国总统绿色化学挑战奖(USA Presidential Green Chemistry Challenge Award)的杀虫药剂,在防治仓储和田间害虫以及动物寄生虫方面具有良好的应用价值和广阔的市场前景。
多杀菌素兼具生物农药的安全性和化学合成农药的速效性,作为农用抗生素的杰出代表,有望成为新一代杀虫剂的主要品种,成为我国生物农药产业一个新的经济增长点。然而现阶段国内对多杀菌素的相关研究仍停留在实验室阶段,产量相对较低,满足多杀菌素工业生产的菌种尚未见报道。
多杀菌素原料药在国内还尚未进行农药登记,相关产品均为美国进口。因此,通过物理化学诱变选育高产菌株,提高多杀菌素发酵产量对我国实现多杀菌素的产业化具有重要意义。传统诱变选育通常采用摇瓶逐个进行发酵培养后测定突变株的目标产量,这种筛选方法工作量大、周期长、消耗大量培养基的同时筛选数量也受到限制。本研究利用课题组建立的96孔板发酵培养结合快速生物测定的高通量筛选方法,通过亚硝基胍(NTG)对刺糖多孢菌ASAGF73进行诱变选育,缩短了筛选周期的同时增大了筛选量,为多杀菌素工业生产菌种的选育奠定了基础。
1 材料与方法
1.1 菌种及培养基
1.1.1 供试菌株
刺糖多孢菌ASAGF73由国家粮食局科学研究院发酵生物技术实验室筛选和保藏。
1.1.2 培养基
斜面和平板培养基(g/L):葡萄糖5.0,牛肉膏3.0,酪蛋白胨0.25,琼脂15.0,pH7.2。
96孔板高通量筛选培养基参照文献。
摇瓶种子培养基(g/L):葡萄糖15.0,可溶性淀粉10.0,豆饼粉3.0,棉籽蛋白3.0,大豆蛋白胨25.0,MgSO4 2.0,pH7.2。
摇瓶发酵培养基(g/L):葡萄糖7.0,棉籽蛋白20.0,NaCl 3.0,K2HPO4·3H2O 0.2,FeSO4·7H2O 0.05,CaCO3 1.0,pH7.2。
上述培养基均在115℃灭菌25min。
1.2 主要试剂和仪器设备
CH3CN和CH3OH(色谱纯,德国Merck公司),spinosad标准品(纯度为98%,美国Sigma公司),Na2S2O3(分析纯,国药),丙酮(分析纯,国药)。
全自动移液工作站epMotion 5070(德国Eppendorf公司);ISF12X恒温恒湿摇床(瑞士阿道夫科耐公司);HPS-400生化培养箱(哈尔滨市东联电子技术开发有限公司);Eppendorf AG 22331 Hamburg型离心机(德国Eppendorf公司);Waters 515/2487型高效液相色谱仪(美国Waters公司)。
1.3 菌株的诱变和筛选
1.3.1 孢子悬液的制备
取一支培养成熟的新鲜菌种斜面,加入15mL 0.02%无菌葡萄糖溶液进行冲洗,通过无菌竹签将表面的孢子轻轻刮下,转移至无菌试管中,于漩涡混合器上震荡5min左右,再利用孢子过滤器过滤制得孢子悬液,调整孢子浓度约108个/mL,29℃摇床振荡6h,使孢子萌发备用。
1.3.2 NTG溶液的制备
称取10mg NTG于Eppendorf管中,加入1mL丙酮充分溶解,配制成10mg/mL的NTG母液。
1.3.3 NTG诱变
采用浓度为1mg/mL和2mg/mL的NTG溶液对孢子悬浮液进行诱变处理。各取900μL和800μL萌发好的孢子悬浮液于Eppendorf管中,再分别加入100μL和200μL NTG母液,混匀,使诱变浓度分别为1mg/mL和2mg/mL。将孢子悬液分别处理10、20、30、40、50min,2500r/min离心10min收集孢子,无菌水重复洗涤3次后,取100μL孢子悬浮液稀释涂平板,每个梯度设置3个重复,29℃培养7d。含NTG的废液,倒入饱和Na2S2O3废液缸中,反应12h以上后进行常规处理。
1.3.4 高通量筛选方法
为了快速高效、低成本地从大量的突变株中筛选获得多杀菌素高产菌株,本实验室建立了96孔板发酵培养结合生物测定的高通量筛选方法。96孔板培养条件参照文献,按常规稀释涂平板法分离单菌落,挑取饱满的单菌落在96孔板中进行培养,将培养好的发酵液加入2倍体积的甲醇浸提多杀菌素,随后将甲醇吹干后用水复溶,然后使用蚊子幼虫(由中国疾病预防控制中心传染病预防控制所提供)进行生物测定。选取产量提高的菌株进行摇瓶复筛验证,复筛验证时每个菌株设置3个重复。高产菌株筛选流程如图1所示。
1.3.5 多杀菌素发酵产量的HPLC测定方法
取一定体积发酵液,加入2倍体积的甲醇,充分振荡混匀后,静置30min,4000r/min离心20min,取上层清液进行HPLC分析,分析条件为:C18反相柱(ZORBAX EcllipeXDB-C18, 4.6mm×100mm,3.5μm);流动相为乙腈:甲醇:水(45:45:10, 含0.05%乙酸铵, V/V/V);进样量为10μL;流速为 1.0mL/min;检测波长为244nm。根据多杀菌素A和D组分的积分面积,参照标准品计算其质量浓度,两组分之和为多杀菌素发酵产量。
1.4 数据处理
采用Origin8.0和SPSS16.0统计学软件进行统计比较处理和显著性分析。计算方法和公式如下。在高通量培养系统误差存在的条件下,突变株发酵产量是出发菌株产量110%以上的菌株统计为正突变菌株;突变株发酵产量是出发菌株产量90%以下的菌株统计为负突变菌株。
总突变率=正突变率+负突变率
致死率(%)=(U-T)/T×100
(U:诱变前的总菌落数;T:诱变处理后的总菌落数)
最高发酵产量相对值(%)=FP/TP×100
(FP:某剂量最高发酵产量;TP:出发菌株发酵产量)
多杀菌素产量=平均值±标准偏差![]()
2 结果与分析
2.1 96孔板发酵培养
为了验证96孔板发酵培养时不同孔板同一位置的平行性和同一孔板不同位置的稳定性,在已优化的培养条件下,挑取同一株菌的单菌落进行3批发酵培养,每批实验同一孔板选取5个不同位置(如图2所示),每个位置设置3个重复,通过HPLC法测定多杀菌素发酵产量,经过统计处理和显著性分析,结果如表1所示。
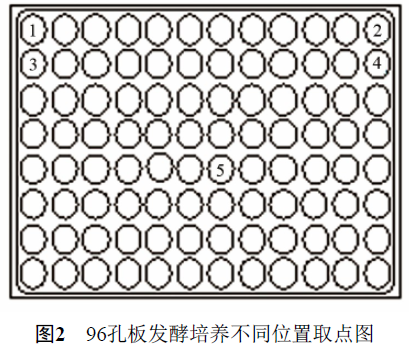
由表1可知,在相同的培养条件下,3批实验均表明同一孔板不同位置间的发酵产量差异不显著(P<0.05),重复验证的系统误差均控制在10%以内,说明96孔板发酵培养系统具有良好的平行性和可靠性。
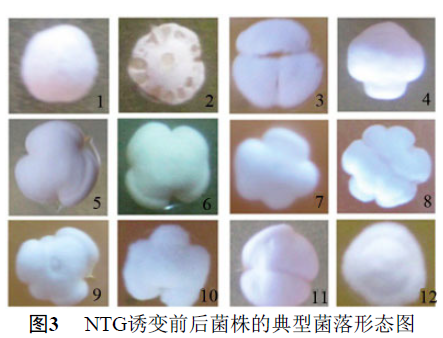
2.2 NTG诱变后突变株的菌落形态变化
经NTG诱变后,部分突变株的菌落形态发生了改变,其菌落形态大致可分为11类(编号2~12)如图3所示。出发菌株(编号1)的菌落形态呈馒头型,表面无褶皱,白色;编号为2的菌落中心凹陷,表面孢子略带灰红色,褶皱边缘呈水滴状;编号3~11与出发菌株形态相比,表面凹凸或边缘形成褶皱,编号12的菌落形态呈草帽状。突变株经摇瓶发酵和HPLC检测多杀菌素产量结果显示,菌落形态呈水滴状的突变株均为负突变,基本不产多杀菌素;菌落形态呈草帽状的突变株均为正突变,多杀菌素发酵产量与出发菌株相比均有较大幅度提高。
2.3 NTG诱变浓度和时间对刺糖多孢菌的诱变效应
由表2可知,NTG浓度为1mg/mL时,不同的处理时间所获得的突变株正突变率呈先增加后减小的趋势,在诱变处理40min时达到最高23.68%。而负突变率随诱变时间的延长而逐渐增加,诱变50min总突变率达到70.40%,此时初筛最高发酵产量相对值最高,为152.46%。
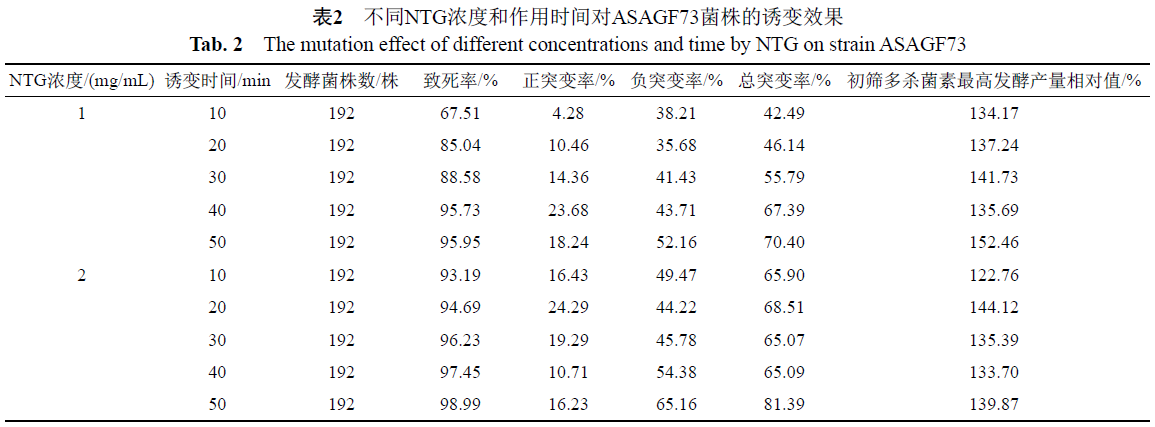
较高浓度的NTG(2mg/mL)对菌株的致死效应明显强于低浓度的NTG(1mg/mL),处理10min致死率就达到了93.19%,随着处理时间的延长,致死率和负突变率均逐渐增加。正突变率随诱变时间呈S型变化趋势,20min时达到最高24.29%,随之降低,在50min时又呈现增高的趋势,此时致死率和总突变率最高分别达到98.99%和81.39%,最终筛选出高产且遗传稳定性良好的菌株多来自于这一诱变剂量。
2.4 突变株的初筛和复筛
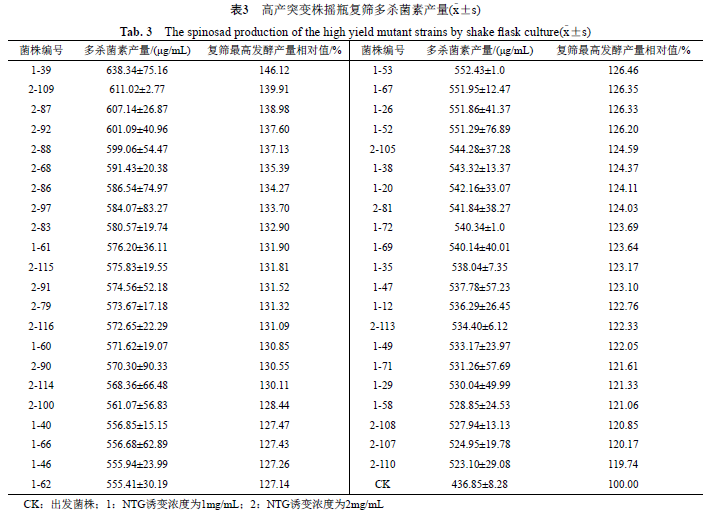
以ASAGF73为出发菌株进行诱变,挑取1920株单菌落于96孔板中发酵培养,生物测定从初筛结果中选取150株高产突变株,进行摇瓶复筛。经统计分析,多杀菌素发酵产量高于出发菌株的突变株编号及产量如表3所示。结果显示,发酵产量提高了20%以上的突变菌株共计43株,其中产量提高30%以上的共计17株。多杀菌素发酵产量初筛和复筛结果显示大多数高产菌株产量稳定,但部分菌株发酵产量会出现一定的偏差,这可能与菌株的自身修复基因有关。
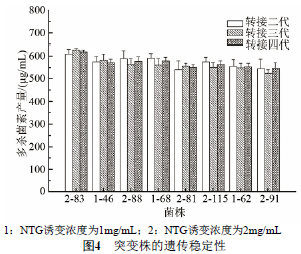
2.5 高产突变株的遗传稳定性
由于突变体在传代中可能出现表型延迟现象,导致筛选到的高产菌株经传代后发酵产量降低。因此,对筛选到的高产突变株进行了遗传稳定性的验证,结果如图4所示。经过连续转接四代,多杀菌素发酵产量较出发菌株提高20%以上的突变株共计8株。NTG诱变的突变株经转接四代后,83、81和91号多杀菌素发酵产量相比转接第二代时分别提高2.12%、1.90%和0.64%,而46、88、68、115和62号多杀菌素发酵产量与转接第二代相比分别降低1.30%、2.82%、2.73%、0.30%和0.64%,但总体变化幅度在10%以内。以上结果表明,筛选获得8株遗传稳定的高产突变株。
3 讨论
本实验利用1mg/mL和2mg/mL浓度的NTG考察其对刺糖多孢菌孢子的诱变效果。NTG对细胞具有很强的杀伤力,能改变菌株自身的遗传性状,使菌落形态发生变化。最后筛选到比出发菌株发酵产量提高20%以上的菌株有8株,并通过转接实验验证了这些菌株具有较好的遗传稳定性。其中,2mg/mL的浓度比1mg/mL致死效应明显增强,在2mg/mL诱变50min时,致死率和负突变率最高,而正突变率未高于其他诱变剂量,但最终筛选出来的高产稳定菌株多数来自于这一浓度,表明诱变效果与致死率和突变率之间无明显相关性。国内关于NTG诱变选育多杀菌素高产菌株进行了一些研究。徐晴雨等通过5mg/mL的NTG溶液诱变选育多杀菌素高产菌株,获得了较出发菌株提高8.6%的突变株。李丽等开展了不同浓度NTG诱变刺糖多孢菌的研究,在2mg/mL剂量下筛选到一株产量提高28%的突变菌株。这些研究结果表明通过NTG诱变选育多杀菌素高产菌株是一种切实可行的方法。
另外,在建立筛选多杀菌素高产菌株的方法上,采用96孔板发酵培养结合生物测定高通量筛选进行初筛,在本研究中得到了很好的应用,为定向选育多杀菌素高产菌株提供了指导。与常用的采用摇瓶逐个进行发酵培养后测定突变株的目标产量相比较,在相同的时间内,本高通量筛选方法可以增大筛选通量,减少培养基用量,降低成本。HPLC完成一个样品的检测需要10min,即测定2000个样品需时2~3周,而采用生物测定的方法,可以在一天内完成样品的测定,大大缩短了筛选的周期。该方法不仅为多杀菌素工业生产菌的选育奠定了基础,也适用于其它微生物菌种的大规模高效筛选。
为了保证实验结果的准确性、可靠性和可重复性,在使用96孔板发酵培养时,首先要有供菌株生长的可溶性液体培养基;其次,要保证培养过程的温度和湿度恒定。生物测定也需在温度、湿度恒定的条件下,选择大小一致、敏感性强的蚊子幼虫,并在添加幼虫过程中防止机械致死和样品间的交叉污染。另外,观察期间避免剧烈震荡,防止对幼虫产生致死效应。
| 相关附件 |


