玉米赤霉烯酮降解微生物的筛选与鉴定
- 时间:2016-09-08
黄哲 孙长坡 伍松陵 常晓娇 屈凌波
玉米赤霉烯酮(Zearalenone,简称ZEN,又称F-2毒素)分子式为C18H22O5,分子量为318.36g/mol,熔点为164~165℃的白色晶体,是真菌产生的一类次生代谢物质,易溶于碱性水溶液、乙腈、乙醚、苯、氯仿、乙酸乙酯、甲醇及乙醇等。ZEN产生菌株主要是镰刀菌属(Fusarium),如禾谷镰刀菌(F.graminearum)和三线镰刀菌(F.tricinctum)等。
ZEN主要污染玉米、小麦、大米、大麦、小米和燕麦等谷物,可直接通过污染的谷类等作物进入人和动物体内,亦可通过被污染的肉、奶等动物性食品进入人体,具有较强的生殖毒性和致畸作用,可引起动物与人发生雌激素中毒症,因此日益受到重视。已有研究表明,人体外围的单核血细胞在ZEN的环境中将引发抑制免疫效应,ZEN也会在一定程度上导致女性子宫肥大和子宫内膜腺癌的患病机率的提高。据联合国粮农组织统计,每年全球有多达25%的食品和原料被ZEN污染。我国储粮中ZEN污染较为严重。国家粮食储备局成都粮食储藏科学研究所于2004年对东北三省及河南、河北、山东、内蒙、新疆等地的小麦和玉米样品进行抽样检测,结果发现,小麦和玉米中ZEN含量超标率分别高达72.9%和84.8%。目前,削减储粮中ZEN的含量并降低霉变粮食的危害成为当前粮食质量安全的重要任务。常见的ZEN脱毒方法有物理、化学和生物三大类,物理脱毒方法有高温法、辐照法、压煮法等。采用添加霉菌毒素吸附剂的办法,不仅在吸附毒素的同时还会吸附营养成分,并且对ZEN的毒性去除不彻底。化学方法包括氨化法、碱法、臭氧处理、双氧水处理、碳酸钠浸泡等,但这些方法效果不稳定,营养成分损失较大,且降解产物成分复杂,毒副作用较大,容易造成二次污染。生物脱毒法是通过微生物产生的次级代谢产物或者所分泌的胞内、胞外酶分解破坏霉菌毒素分子的毒性基团,同时产生无毒或低毒降解产物的过程。这种脱毒方法由于专一性降解,不会破坏原料中的其他成分,不会降低营养价值。所以生物降解法是去除ZEN较为有效及可行的方法。目前国外已分离到一些可降解ZEN的菌株,如Cho K G筛选出的一株枯草芽孢杆菌,Hideaki分离出的粉红螺旋聚孢霉。Orsoly从白蚁肠道中分离出的解毒Trichosporon等。国内刘海燕等利用粉红粘帚霉菌株总RNA为模板对其ZEN降解酶基因进行克隆并在毕赤酵母中高效表达。
本研究内容是对全国各地采集的样品先进行菌株的分离纯化后,再对单个菌株进行ZEN降解能力的测定。本研究采用的筛选体系具有ZEN用量少、实验周期较短、菌株无需再次分离纯化等优点,可快速、高效地筛选出具有ZEN降解效果的菌株。本研究获得的两株对ZEN降解效果良好的菌株可为发掘内在的ZEN降解功能基因提供菌株资源。
1 材料与方法
1.1 主要材料和设备
样品:从全国ZEN污染严重及人类活动较少的地区采集土壤或发霉玉米、小麦等粮食样品,鸡肠道微生物和动物粪便等。
试剂:甲醇、乙腈色谱纯级:购于北京DIKMA公司;ZEN标准品:购于sigma公司;常规试剂均为市售。
菌株分离纯化培养基:Luria-Bertani(LB)培养基;高盐察氏培养基;YPD培养基;ZEN降解菌株筛选的无机盐液体培养基包括:(NH4)2SO4、MgSO4·7H2O、CaCl2、Na2HPO4、KH2PO4。
仪器设备:高效液相色谱(e2695):美国WATERS公司;厌氧工作站:英国RUSKINN公司;二级生物安全柜:美国ESCO公司。
1.2 方法
1.2.1 菌株分离与纯化
将样品用无菌水梯度稀释,取10-3和10-4梯度的菌悬液各0.1mL分别于LB、YPD和高盐察氏的固体平板培养基上涂布,LB和YPD平板置于37℃培养24h,高盐察氏平板于30℃培养28h;肠道微生物的分离、纯化、培养操作均在厌氧工作站中进行。培养结束后挑取菌落形态各异的单菌落进行平板划线培养,取纯化后的单菌落于斜面培养基划线保存。
1.2.2 降解玉米赤霉烯酮菌株的初筛
取一定浓度的ZEN甲醇溶液加入已灭菌的2mL离心管中,于离心真空浓缩仪55℃蒸干,加入500μL无机盐培养基,用接种环挑取一环菌体进行接种,然后置于30℃恒温摇床进行振荡培养;培养2周后进行降解率的测定。经过HPLC检测后,再对ZEN含量降低的菌株样品进行复检以保证菌株对ZEN的降解性能。
1.2.3 降解玉米赤霉烯酮菌株的确证
按照方法1.2.2重复培养后,参照国家标准GB/T 5009.209—2008,对培养好的离心管进行蒸干、甲醇复溶、超声加速溶解后过0.22μm的有机相膜。用甲醇稀释10倍后取1mL装入液相小瓶,用于高效液相色谱(HPLC)检测其ZEN含量。ZEN降解率的计算公式为:
ZEN降解率=(空白对照组含量-样品组含量)÷空白对照组含量×100%。
色谱柱:C18柱(250mm×4.6mm,5μm,xbridge);流动相:水/乙腈=50/50(V/V);流速1.0mL/min;柱温25℃;进样量5μL;荧光检测器:激发波长(Ex)=274nm,发射波长(Em)=440nm。
1.2.4 降解玉米赤霉烯酮菌株的初步鉴定
对降解能力较好的菌株进行显微镜革兰氏染色观察,并使用细菌鉴定通用引物16sr、16sf及放线菌鉴定通用引物R513、F248进行PCR扩增,对菌株的分类进行初步鉴定。25μL PCR扩增体系为:上下游引物各0.5μL;模版1μL;TAKARA-mix12.5μL;加无菌水至总体积25μL。PCR反应程序为95℃/30s;95℃/30s、56℃/30s、72℃/1min,30个循环;72℃/5min;4℃保存。
1.2.5 降解曲线的制定
取降解率较高的菌株按方法1.2.2设立5组平行实验,通过不同培养时间测定降解率与培养时间的曲线关系。
2 结果与分析
2.1 菌株的分离纯化
将采集到的134份样品按照方法1.2.1进行分离纯化,分别在LB、YPD、察氏培养基上进行培养,共分离得到1628株菌落形态各异的菌株,具体情况见表1。
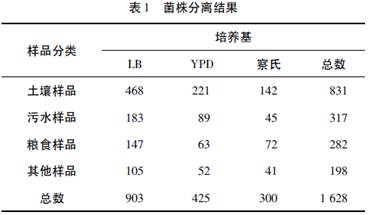
由表1可以看出:土壤样品中含菌株种类较多;LB培养基中可分离出较多菌落形态各异的菌株。
2.2 ZEN降解菌株的初筛
将分离纯化所获得的1628株菌株按照方法1.2.2进行ZEN降解菌株的筛选,并按方法1.2.3测定其降解率,共获得可降解ZEN的菌株8株,8株菌株对应样品信息见表2,对ZEN降解率见图1。
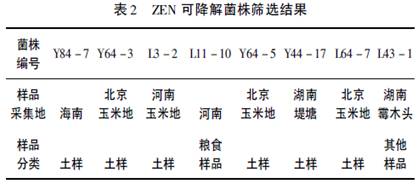
从图1中可知Y64-3和Y84-7的降解效果最优,分别达到60.08%和54.90%。结合表2和图1分析可知,在受赤霉病污染的玉米地采集的土样中分离出的菌株具有较好的降解ZEN的能力。南方湿热环境下的样品也较易获得对毒素ZEN具有降解作用的菌株。
2.3 菌株复筛结果
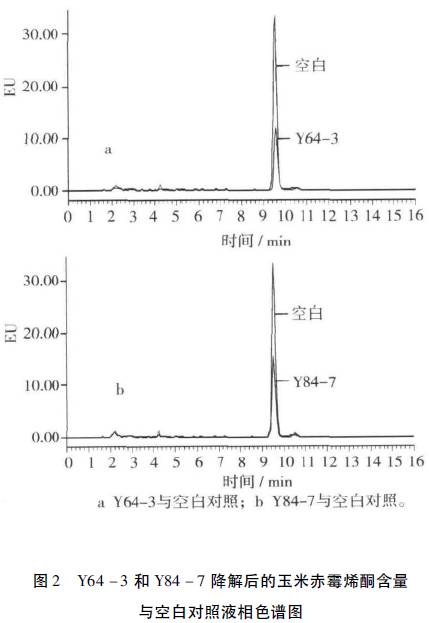
将菌株Y64-3及Y84-7取一式五份平行样按方法1.2.2及1.2.3操作,检测结果表明,玉米赤霉烯酮的相对标准偏差(RSD)为1.4%,重复性良好。由图2可以看出菌株Y64-3和Y84-7对ZEN的降解效果显著。
2.4 菌株对ZEN的降解曲线
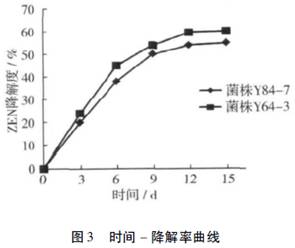
对分别培养3、6、9、12、15d的菌株Y64-3和Y84-7进行降解率的测定。结果见图3,从图3中可知随着培养时间的延长,菌株的ZEN降解率逐渐增大,这是因为菌株利用ZEN作为碳源供菌株生长代谢所需。而12d后其降解率趋于平稳的原因可能有多方面,碳源、氮源、无机盐离子浓度的下降或代谢产物的产生都有可能对其降解率产生影响,以上因素对降解率的影响有待进一步研究。
2.5 初步鉴定
2.5.1 形态鉴定
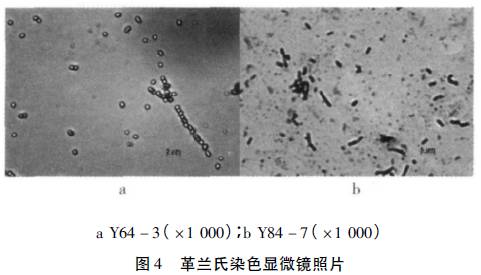
对菌株Y64-3和Y84-7进行革兰氏染色涂片放大一千倍观察,形态见图4。观察所得2株菌株均为革兰氏阳性菌。
2.5.2 分子鉴定
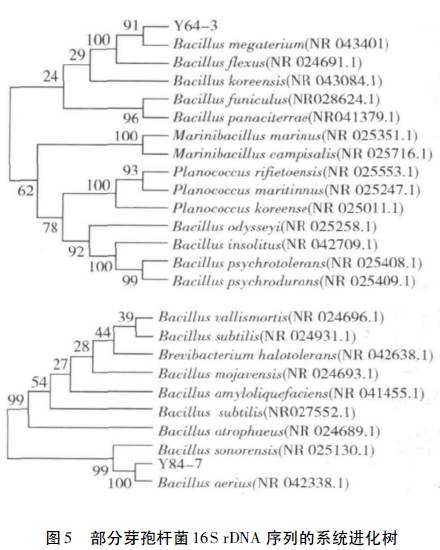
将经酶切和PCR扩增验证得到的16srDNA基因片段进行测序,并对测序结果进行相关分析。BLAST比对结果显示:Y64-3、Y84-7与芽孢菌(Bacillus)的序列相似性很高。根据序列比对结果,利用MEGA5软件构建了系统进化树(图5)。分析细菌16srDNA的系统进化树,初步确定2株降解菌株均为芽孢菌属。
3 结论
本研究建立了以ZEN为唯一碳源进行降解菌株的高通量筛选方法,实验表明该方法具有ZEN用量少、实验周期较短、菌株无需再次分离纯化等优点。筛选了多种样品中所能降解ZEN的菌株,并对菌株进行了简单分类,得出在受赤霉病污染的玉米地采集的土样中,分离出的菌株具有较好的降解ZEN的能力。南方湿热环境下的样品也较易获得对ZEN具有降解作用的菌株。并且在菌株筛选时,将寻找范围确定在细菌和放线菌上更易于找到玉米赤霉烯酮的降解菌株。
经过对全国各地的各种样品进行筛选所获得的8株菌株,都能对ZEN产生一定的降解作用,经过复筛,得到对ZEN降解效果较明显的2株菌Y64-3及Y84-7。降解ZEN菌株的获得为下一步克隆相关功能基因提供了很好的菌株资源。| 相关附件 |


