呕吐毒素(DON)生物合成和降解研究进展
- 时间:2016-09-08
曹慧英 伍松陵 孙长坡
真菌毒素是霉菌产生的有毒次生代谢产物。真菌毒素污染粮食或饲料后,给人类健康和畜禽生产带来巨大威胁。Yoshizawa等从污染的玉米中分离得到脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON),并根据它能引发母猪拒食和呕吐的特征,将其定名为呕吐毒素(Vomitoxin,VT)。DON主要由禾谷镰刀菌(Fusarium.graminearum)和黄色镰刀菌(F.culmorum)产生,该两株菌是引起小麦赤霉病和玉米穗腐病的病原菌。家畜食用DON污染的饲料会引起拒食,呕吐,生长延迟,生殖紊乱等症状;而人类误食DON污染的粮食会引起免疫抑制,贫血,头痛,呕吐,厌食和腹痛等症状。DON污染粮食已经成为畜产品生产和人类健康的严重威胁,DON污染的防治迫在眉睫。本文综述了DON的物理化学性质,生物合成途径及生物降解的研究进展,为寻求有效的防治手段做到“知己知彼”。
1 DON物理化学特性
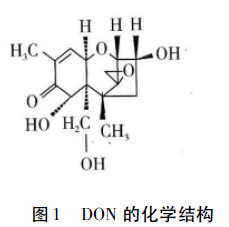
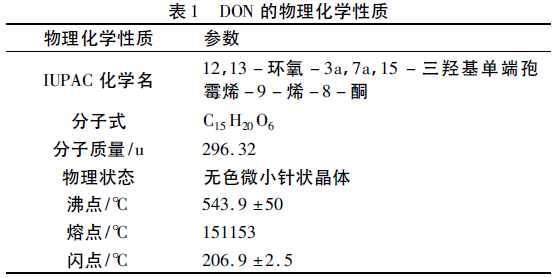
DON的IUPAC化学名为12,13-环氧-3a,7a,15-三羟基单端孢霉烯-9-烯-8-酮,为一种倍半烯衍生物(图1),DON各种物理化学性质见表1。DON属于B类单端孢霉烯,该类毒素的特点是在C8位具有一个酮基,该酮基使其在短波紫外下有吸收峰,但与其他物质紫外吸收峰相重叠,并非特征性吸收。DON易溶于水和极性溶剂甲醇、乙醇、乙腈、丙酮及乙酸乙酯,但不溶于正己烷和乙醚。研究证实DON在有机溶剂中稳定,乙酸乙酯和乙腈是长期储存最适合的溶剂。DON耐热、耐压,弱酸中不分解,而加碱及高压处理可以破坏其部分毒力。DON的耐藏力也很强,据报道病麦经4年的贮藏,其中的DON仍能保留原有的毒性。研究认为12,13-环氧结构是其具有毒性的主要结构基础,DON的环氧结构耐煮沸,烘焙,甚至是135℃的高温蒸汽。
2 DON的生物合成
单端孢霉烯族毒素的生物合成需要经过一系列的酶促反应,研究表明,在禾谷镰刀菌(F.graminea-rum)基因组中,约有1216个相关的单端孢霉烯族毒素合酶基因(trichothecene)参与DON的生物合成,第一个被鉴定和克隆的trichothecene基因为TRI5,其他基因聚集在TRI5合酶基因周围形成一个25kb的基因簇。基于大量深入的研究,DON生物合成相关基因的功能逐渐被阐明,且合成途径也逐渐清晰(图2)。起初,研究者通过基因敲除和插入突变的方法,获得TRI基因突变的镰刀菌突变菌株,来探寻DON的降解途径。此外,研究者通过外源表达TRI基因来研究该基因在合成途径中的作用。尽管图2显示DON合成是分步的过程,但其生物合成途径是一种复杂的代谢网络,目前这些合成步骤的顺序并不确定。然而,合成途径的第一步是法呢基焦磷酸(FPP)在trichodiene合成酶TRI5的催化作用下,被环化生成无毒的trichodiene。研究者通过纯化TRI5在体外证实了这步反应,F.graminearum与F.sambucinum的TRI5基因突变体丧失了DON中间体及DON的合成能力。
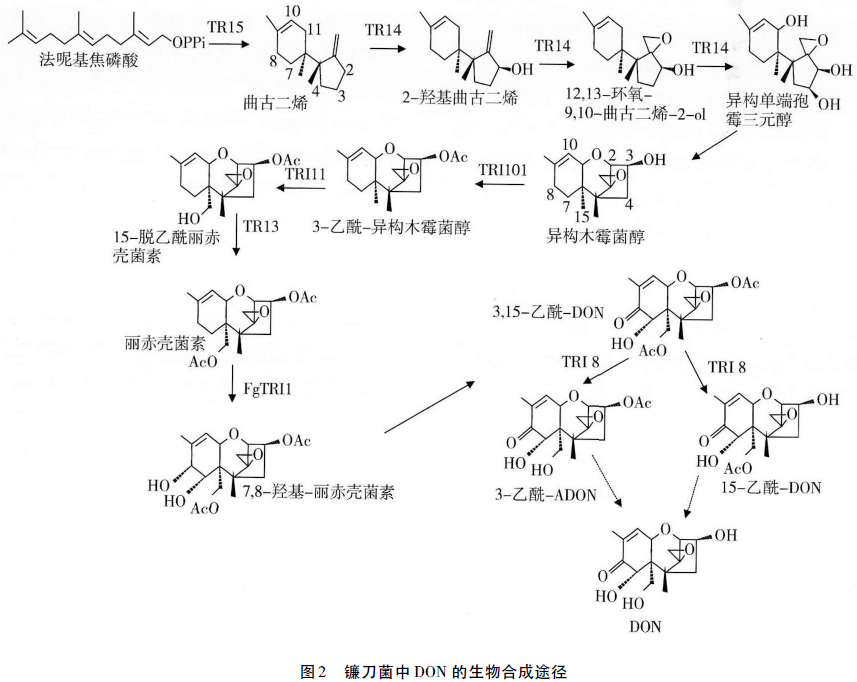
曲古二烯在多功能的细胞色素P450单氧酶TRI4催化作用下经4步反应,即C2羟基化,C12,13之间环氧化,C11羟基化,C3羟基化,生成产物Isotrichotriol。两项独立研究证实了上述4步反应,研究者分别在不产DON的镰刀菌(F.verticillioide)和酿酒酵母(Saccharomyces cerevisiae)中表达了TRI4基因,结果所表达的TRI4酶均能催化这4步反应,而TRI4基因突变的F.graminearum菌株无法完成上述4步反应。
异构单端孢霉三元醇(Isotrichotriol)继续经历无需酶催化的两步异构化反应,即C9的羟基转变成C11羟基,C2上氧原子与C11之间经环化作用形成—CO键,生成产物异构木霉菌醇(Isotrichodermol),该产物是单端孢霉烯族的骨架结构。异构木霉菌醇在乙酰基转移酶TRI101催化下,其C3上羟基被乙酰化。研究证实F.graminearum与F.sporotrichioides的TRI101基因突变体只能完成C3乙酰化之前的合成反应,在酵母中表达的TRI101酶可以催化C3的乙酰化反应。
随之,C15位在细胞色素P450单氧酶TRI11的催化下被羟基化,生成15-脱乙酰丽赤壳菌素(15-deacetylcalonectrin),该产物是DON生成的直接底物,经过C3位和C7位的羟基化作用及C8位变为酮基后,最终生成DON。此外,15-脱乙酰丽赤壳菌素也可在乙酰化转移酶TRI3催化下,C15位羟基被乙酰化,生成产物丽赤壳菌素,它是乙酰化DON和NIV类产物生物合成的底物,随后经不同途径可分别生成T-2,NIV与DON,这表明3种毒素在丽赤壳菌素生成前的合成途径是相同的。
在DON的生物合成过程中,每一步反应都需要有相应的TRI基因编码的酶参与完成,目前许多研究正通过基因鉴定来阐明单端孢霉烯族的合成过程,因此,结合化学结构和基因遗传分析单端孢霉烯族的生物合成过程,可以更好的了解单端孢霉烯族的演变过程,同时对于DON生物降解的研究具有重要作用。
3 DON的生物降解
目前,国内外有关DON生物降解的研究正成为热点。主要包括酶降解法和微生物脱毒法两种方式,而微生物降解是目前对真菌毒素污染削减研究的重点。
DON中推测的作用位点主要包括,C12,13位的环氧结构、C3—OH基团、C8酮基、C15位等(图3)。研究表明,DON的C12、C13位的环氧结构和C3—OH基团是DON的主要致毒基团,因此这两个基团是DON降解中主要研究的位点。早在20世纪70年代,Sato等就明确了C12和C13位的环氧结构是DON致毒的主要因素,该环氧结构可抑制蛋白质的合成,也是B类单端孢霉烯的作用方式。在单端孢霉烯中报道了2种破坏C12和C13位环氧结构的方式,还原剂破坏环氧结构后生成烯烃,水解作用破坏环氧结构后生成两个相邻的—OH基团,推测环氧结构的破环是植物中的硫醇类物质对环氧结构的亲核攻击所致。Yoshizawa等报道,动物肠道中的细菌可以分解单端孢霉烯中的环氧结构,DON的降解产物为C9和C12形成双键的物质。随后,两个独立研究均证实了牛瘤胃和肠道中的混合微生物可将单端孢霉烯中的环氧结构破坏;而牛瘤胃和肠道中的纯培养物很难破坏DON的环氧结构,因为这些细菌严格厌氧且具有复杂的营养需求。在发现单端孢霉烯可以被脱环氧化之后,Matsushima等从动物消化系统中分离获得了能够水解单端孢霉烯酯键的厌氧菌。Binder等首次从牛瘤胃的富集培养物中分离到一株厌氧优杆菌属细菌(Eubacterium BBSH797),该菌可以在2448h转化DON和其他单端孢霉烯族毒素,从而部分地减轻饲料中毒素的毒性;Fuchs等采用气质联用(GC/MS)和颗粒束界面-质谱联用(LC-PB-MS)方法,重新确定了BBSH 797菌株降解DON的代谢产物为DOM-1;He等发现,鸡肠道中微生物在96h内可转化98%以上的DON标品,转化产物鉴定为DOM-1,可将DON的环氧环打开,产物毒性远远低于DON。Eriksen等通过毒性试验研究发现,DOM-1的毒性为DON的1/55,目前它是DON毒素降解中毒性最低的产物。
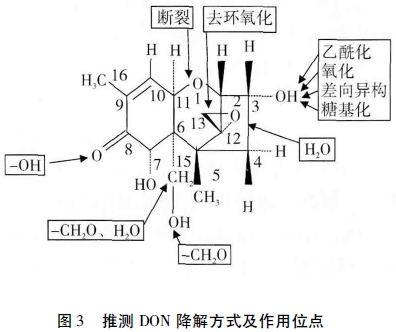
除了C12、C13位的环氧结构外,C3—OH基团对DON的毒性也起着主要作用。DON中C3位的降解方式主要有乙酰化、糖基化、氧化和差向异构(图3)。在DON的合成过程中,C3位羟基的乙酰化形式可以作为中间产物抑制DON的合成,从而保护作物抵制DON的毒害,因此DON乙酰化酶已经被应用在植物抗病育种中。Kimura等首先从禾谷镰刀菌(F.graminearum)中分离获得了编码单端孢酶烯3-O-乙酰转移酶的Tri101基因,并证实Tri101能使单端孢酶烯转化为类似单端孢酶烯C—3羟基变种的乙酰基衍生物,从而降低其毒性,结果表明,DON的C3—OH乙酰化后减少了DON对家兔红细胞的毒性。同时,研究者从拟分枝孢镰刀菌(F.sporotrichioides)中分离到同源的Tri101基因,并通过转基因的方法将其成功地转到酵母和烟草中。由于Tri101基因能降低单端孢酶烯的毒性,Alexander等将Tri101基因导入小麦和大麦中,结果显示,导入该基因的转基因植物的病害程度降低了,从而证明通过导入一个毒素修饰基因,能够降低小粒谷类作物赤霉病和DON的积累。基于上述研究,研究者对Tri101基因的结构和功能进行了全面深入的研究,Garvey等详细分析了3-O-乙酰转移酶的三维结构和动力学特性;Khatibi等表达纯化了Fusarium中7个种的3-O-乙酰转移酶,通过对比Fusarium不同种的3-O-乙酰转移酶的特性,获得了适合生物应用的最优的酶资源。上述研究表明,Tri101基因的表达在转基因育种中具有潜在的应用前景。
DON的C3—OH基团另一种转化方式为糖基化,Miller等提出在小麦悬浮液中存在DON和葡萄糖结合态的产物,Sewald等随后也提出在玉米悬浮液中也存在该产物,并命名C3—OH糖基化后的结合态产物为3-β-D-glucopyranosyl-4-DON(图4a),降解产物的相对分子质量为458,Poppenberger等证实了完整结合态产物的产生,并申请了专利保护。Lemmens等进一步定位了DON到DON-3-glucoside的转化,并研究了其存在于小麦中时小麦对FHB的抗性能力,证明DON糖基化的形式是小麦抵抗FHB侵染的一个主要的抗性因子。Berthiller等首次报道了在镰刀菌侵染的小麦和玉米中自然存在的DON-3-glucoside,表明该产物在DON污染的小麦和玉米中的比例为46%,以人工合成的DON-glucoside为对照,采用液质联用(LC/MS)的方法,验证了DON-3-glucoside及其产物。综上所述,葡萄糖基转移酶的研究对于作物抗性育种将会是一个潜在的策略。
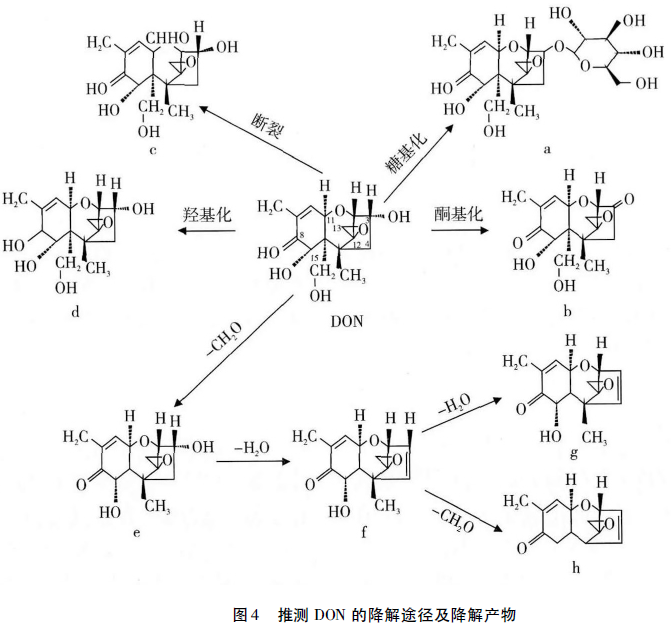
DON的C3—OH基团的氧化作用和差向异构形式也逐渐被研究和报道,DON的C3—OH氧化后的产物为3-酮基-DON(图4b)降解产物的分子质量为294。研究证实,可以将DON的C3—OH氧化后变为3-酮基-DON的菌株有3种:Shima等从土壤中分离到一株属于土壤杆菌—根瘤菌属的细菌Agrobacterium-Rhizobium;Volkl等从德国分离获得一种混合培养物D107;Zhou等从加拿大分离获得一株未命名的细菌。以上3种该菌能够把DON转化为3-酮基-DON,从而减少DON在免疫抑制方面的毒性。DON的C3位差向异构方式为C3—OH先变为C3=O,后C3=O又变为C3—OH,O原子和H原子在空间位置上相互异构。目前报道有3种菌中存在DONC3—OH的差向异构方式:Ikunaga等从土壤中分离到一株诺卡氏菌(Nocardioides sp.WSN05-2),在MM培养基中10d后可以完全降解DON;Volkl等从混合培养物D107中分离获得一株α-变形杆菌HOH107,该菌与Devosia riboflavina相近,转化DON的顺序为DON→3-oxo-DON→3-epi-DON;另外一株为Zhou等从加拿大分离获得的未命名细菌。此3种菌株转化DON的差向异构方式相同,中间产物3-oxo-DON均不能积累,且转化均不可逆。
研究报道,其他一些微生物也可以将DON降解,但无具体产物结构的报道。尽管这些菌株降解DON的过程没有明确,但为后续的研究提供了菌株资源。如丝状真菌可以将DON转化为毒性不同的产物。He等分离到一株能够氧化DON的塔宾曲霉(Aspergillus tubingensis)NJA-1,14d内对DON的平均降解率为94.4%,但降解产物未知;徐剑宏等利用富集培养的方法,从土壤和麦穗样品中分离获得一株徳沃斯氏菌(Devosia sp.),将该菌添加到小麦饲料中后,饲料中的DON毒素降解率达到75.47%,未明确降解产物结构。
除了上述主要的降解途径外,推测DON还存在其他可能的降解途径。DON中O1和C11间断裂,通过水合作用水解后均变为—OH(图4c),研究推测分离得到的塔宾曲霉NJA-1是通过水合作用的方式降解DON,DON中C8位的酮基也容易受到亲核基团的攻击变为羟基,并从化学角度分析,C8位的O原子可能被水解,变成2个—OH(图4d)。冯培生等利用UPLC-Q/TOF-MS技术分析了大鼠体外肠道微生物中DON的代谢产物,研究表明,DON中C15去掉—CH2O,形成分子质量为265的中间产物(图4e),在此基础上,C5和C6同时去掉一个CH2O和一个H2O,形成产物分子质量为247(图4f),C6和C7在247的基础上去掉一个H2O,形成分子质量为227的终产物(图4g),产物247降解的另一种方式为C14去掉—CH3,C7去掉—OH,C3和C4形成双键的终产物217(图4h)。总之,明确DON的降解和转化途径,可为实际应用中DON的清除提供可靠的理论依据。
4 展望
国内外的研究表明,DON的生物降解是目前的研究热点,是具有应用潜力的方法。虽然目前有很多关于DON生物降解的研究,但对于DON的转化机理、转化产物的毒性作用及对处理DON污染粮食和饲料后的安全性评价等研究较少,因此,了解DON的物理化学性质,生物合成途径及DON可能的降解方式及作用位点,可为今后研究DON有效的降解途径提供新的思路。
随着生物技术的迅速发展,DON降解酶基因的外源重组表达为真菌毒素污染的削减进行了有益的探索。DON降解酶基因的表达不仅能应用在转基因作物中,使植株自身获得抵抗病菌(如小麦赤霉病)的侵染,从而提高作物产量,而且在污染粮食的处理中也具有广阔的应用前景。目前国内外关于DON降解酶基因及酶制剂的应用较少,期望能获得高效降解DON的菌株,为DON污染粮食的处理提供行之有效的技术和策略,确保粮食和食品安全、保护消费者健康。
| 相关附件 |


