利用PCR——RFLP方法鉴别黄曲霉毒素产毒菌株
- 时间:2016-09-08
孙长坡 常晓娇 伍松陵 沈 晗
0 引言
【研究意义】黄曲霉毒素是真菌毒素中毒性最强的一类可致癌、畸形突变的生物毒素,1993年黄曲霉毒素被世界卫生组织(WHO)的癌症研究机构划定为I类致癌物。其毒性组分最主要的是由曲霉属,特别是黄曲霉、寄生曲霉产生的次生代谢产物,可污染储藏的谷物和熟食制品,除了防控黄曲霉毒素产生菌进入食物链外,开发快速、灵敏的产毒菌株检测方法,用于食品原料和加工过程中的检验,也可避免或降低黄曲霉毒素污染的风险。为粮油储藏和食品生产的安全监测和质量控制提供基于分子水平的早期预警和快速检测新技术。为黄曲霉毒素污染的生物防治提供微生物来源。【前人研究进展】黄曲霉毒素的合成涉及21步酶促反应的复杂过程,参与合成的绝大多数基因聚集在特定的基因簇中,由基因簇的基因转录和翻译而成。基因簇是细胞中比较常见的次生代谢合成现象。基因簇的存在是黄曲霉毒素等次生代谢合成途径的重要调控机制之一。黄曲霉毒素合成途径的关键基因aflR在毒素产生途径中起到非常重要的作用,该基因的表达产物AflR蛋白能够调控黄曲霉毒素途径其它基因的转录,是黄曲霉毒素合成的关键蛋白和主要正性转录因子,大多数黄曲霉毒素合成相关基因都受AflR蛋白的调节。不产毒素的黄曲霉菌与产毒黄曲霉菌之间存在5个变异位点,这些位点可能与黄曲霉毒素的产生有关。【本研究切入点】目前,对黄曲霉毒素合成的研究集中在合成基因簇中各基因转录和翻译及合成关键基因aflR的调控作用上,而对产毒菌株与不产毒菌株在基因序列上存在的差异鲜有报道。国内外针对黄曲霉毒素的检测方法主要为薄层色谱法(TLC)、高效液相色谱法(HPLC)、酶联免疫吸附分析法(ELISA)和生物传感器法。样品前处理方法也多利用免疫亲合柱法(IAC)和多功能固相萃取柱进行纯化处理。这些方法存在对所需设备要求高、检测周期长、成本昂贵、灵敏度及准确度差、并且只能在毒素产生后检测及防控。因此,急需开发一种准确性和灵敏度高、特异性好、可以用于早期预警和生产过程中质量控制的简便、快捷的鉴别方法。【拟解决的关键问题】本研究通过对合成黄曲霉毒素关键基因aflR的生物信息学分析,发现在可能产生黄曲霉毒素的菌株中aflR序列的突变规律,进而建立限制片段长度多态性(RFLP)技术,以期能够快速、准确地区分产毒、不产毒菌株及黄曲霉和寄生曲霉。
1 材料与方法
试验于2013年在国家粮食局科学研究院粮油微生物实验室完成。
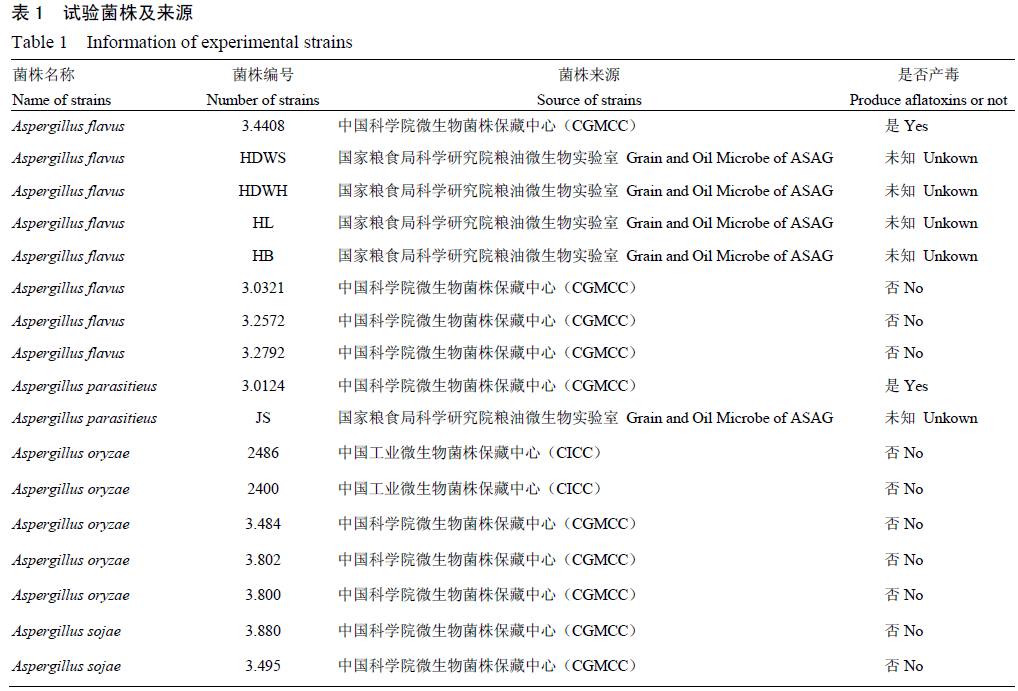
1.1 试验菌株及来源
供试菌株为购自国内多个菌种保藏中心及本实验室保存的从污染的粮食中分离鉴定的黄曲霉(A.flavus)、寄生曲霉(A.parasitieus)、米曲霉(A.oryzae)和酱油曲霉(A.sojae)共计17株,详见表1。
1.2 主要试剂和仪器
DNA Marker、PMD 19-T Vector、限制性内切酶Nhe Ⅰ、Pvu Ⅱ、Hinc Ⅱ,购自TaKaRa公司;KOD-Plus DNA聚合酶,购自北京鼎国昌盛生物技术有限公司;乙腈和甲醇(色谱纯),购自迪马公司;甲醇、二氯甲烷、正己烷、氯化钠(分析纯),培养基及其它生化试剂,购自北京瑞泽康生物技术有限公司;黄曲霉毒素B1、B1、G1、G2标准溶液(纯度>99%),购自美国Sigma公司;免疫亲合柱,购自北京泰乐祺科技有限公司;Agilent 1100型高效液相色谱仪,购自美国安捷伦科技股份有限公司;N.Y.10018,U.S.A光化学衍生器,购自AURA公司;梯度PCR仪,购自美国ABI公司。
1.3 aflR基因的生物信息学分析和引物设计
查找GenBank中已报道的黄曲霉、寄生曲霉、米曲霉和酱油曲霉的aflR结构基因及其启动子序列,用基因分析软件对上述曲霉菌多个菌株的两个序列分别进行生物信息学分析,找出变异位点。根据GenBank中上述基因序列分别设计引物aflR1:5'-AGAATAGCTTCGCAGGGTGGT-3'和aflR2:5'-AGTCTGGGAGGAACGGATCG-3'用于扩增aflR片段;引物PaflR1:5'-AACCGCATCCACAATCTCAT-3'和PaflR2:5'-AGTGCAGTTCGCTCAGAACA-3'扩增aflR启动子片段。
1.4 曲霉菌基因组DNA的提取
挑取各曲霉菌株接种于50mL的PDA液体培养基(去皮马铃薯200g,蔗糖20g,水1000mL)上活化,28℃恒温培养5d;在PDA平板上划线,挑取单菌落接种于PDA液体培养基上,于28℃、220r/min下振荡培养5d;过滤收集菌体,取菌丝0.1—0.2g,用液氮充分研磨,但不能使菌丝融化,将菌丝研磨成粉末状,用灭菌的不锈钢勺转移到加有500μL cTAB提取液的离心管中,轻轻混匀;向管中加入50μL 20%SDS溶液混匀(注:不可强烈振荡),以防基因组DNA断裂,于65℃下保温10min,并不时摇动;加入150μL 5mol·L-1 KAC,混匀,置冰上20—30min后,于4℃、12000r/min下离心15min;转移上清液到另一离心管中,加入等体积的苯酚﹕氯仿﹕异戊醇(25﹕24﹕1)混匀,于4℃、12000r/min下离心10min。取上清液加0.6倍体积的异丙醇,于-20℃下沉淀30min后,于4℃、12000r/min下离心10min,回收DNA沉淀,用70%乙醇洗脱后,再用无水乙醇洗并冷冻真空干燥;先加入300μL ddH2O或TE溶解,再加入10μLRNaseA,于37℃下保温20min;加入等体积的苯酚﹕氯仿﹕异戊醇(25﹕24﹕1),吸取上清液,再用氯仿抽提1次;取上清液,加入1/10体积的3mol·L-1 NaAc,2倍体积的无水乙醇,于-20℃下静置30min(其中乙醇在-20℃预冷过)后,于1200r/min下离心10min;收集菌体,用70%乙醇洗沉淀,并冷冻真空干燥后,加入30L水溶解DNA,于-20℃保存。电泳检测完整性。
1.5 aflR结构基因及启动子的PCR扩增、纯化及测序
分别以上述各菌株的基因组DNA为模板,PaflR1和PaflR2为引物,PCR扩增aflR基因启动子片段。扩增体系:KOD-plus-聚合酶(1U·μL-1)1μL,引物各1μL,MgSO4(25mmol·L-1)2μL,10×Buffer(不含Mg2+)4.0μL,dNTP(2mmol·L-1)4.0μL,模板DNA 1.0μL,加灭菌去离子水至总体积为40L。扩增条件:94℃预变性5min后,94℃ 1min、52℃ 1min、68℃ 1min、32个循环,68℃延伸10min,4℃保存;分别以黄曲霉和寄生曲霉各基因组DNA为模板,aflR1和aflR2为引物,上述体系及条件PCR扩增aflR结构基因片段。
上述PCR扩增产物经凝胶回收后,部分连接PMD19-T Vector,送上海英骏生物技术有限公司测序;部分用于鉴别分析。
1.6 PCR-限制性片段长度多态性分析(PCR-RFLP)
用序列分析软件将测序结果进行比对分析,找出变异的酶切位点,并用PCR-RFLP分析,NheⅠ酶切体系如下:1μL NheⅠ,2μL 10×M Buffer,7μL PCR产物,10μL灭菌H2O;PvuⅡ酶切体系如下:1μL PvuⅡ,2μL 10×M Buffer,7μL PCR产物,10μL灭菌H2O;HincⅡ酶切体系如下:1μL HincⅡ,2μL 10×MBuffer,7μL PCR产物,10μL灭菌H2O;混匀后金属浴37℃恒温反应4h,取20μL酶切产物用1.5%琼脂糖凝胶电泳检测。
1.7 各曲霉菌产毒分析
将活化好的曲霉属各菌株经适当培养,用血球计数板计数,经过适当稀释,调节成浓度为1.5×108个/mL的无菌水孢子悬液,取10mL孢子悬液接种于装有灭菌大豆培养基的100mL的三角瓶中,再加入无菌蒸馏水混匀,固液比为3﹕1,置于28℃恒温培养21d固态发酵等。按照程树峰和高秀芬等的方法进行黄曲霉毒素的萃取。
色谱条件:Venusil XBP反相C18色谱柱(4.6mm×250mm,5μm);进样量10μL;柱温25℃;流动相为甲醇﹕水=50﹕50(V/V);流速1mL·min-1;荧光检测器:Ex=360nm,Em=440nm;采用AURA光化学衍生池柱后衍生。
2 结果
2.1 aflR基因的生物信息学分析和引物设计
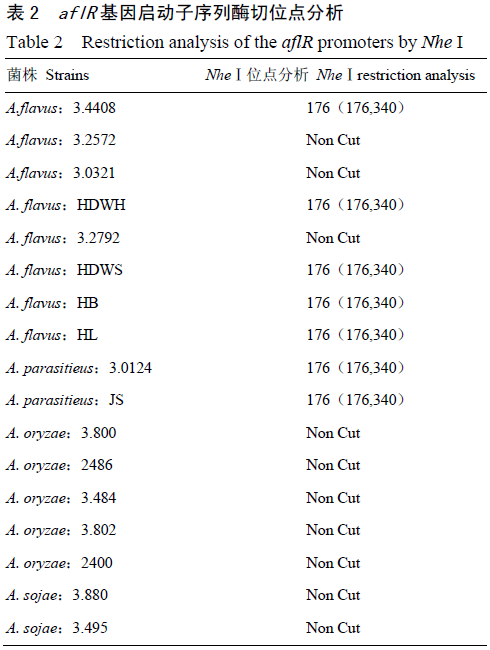
经过对GenBank中大量曲霉菌不同菌株的aflR结构基因及启动子序列的生物信息学分析发现,曲霉菌菌株在上述2个基因序列上虽具有极高的相似度,但仍存在差异,并且呈现一定的规律:aflR启动子序列存在两类序列,酱油曲霉、米曲霉和不产毒黄曲霉的该序列完全相同,寄生曲霉和产毒黄曲霉的序列完全相同,并且两类序列的变异位点中引入了NheⅠ酶切位点的变异;寄生曲霉和黄曲霉的aflR基因序列间的差异造成了HincⅡ和PvuⅡ限制性长度多态性的不同。
2.2 曲霉菌aflR结构基因及启动子序列分析
对曲霉菌菌株PCR扩增结果显示,扩增得到的片段与试验设计的aflR基因启动子序列(515bp)和aflR结构基因序列(798bp)大小一致(图1)。
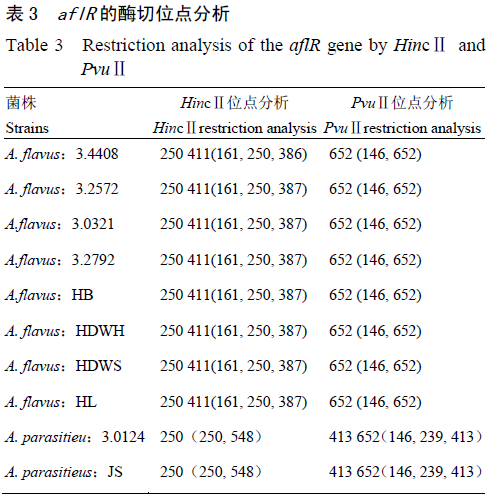
供试曲霉菌各菌株的aflR启动子PCR测序结果,通过DNAMAN对各曲霉菌株的aflR启动子序列进行分析。结果表明,所测的产毒黄曲霉菌之间aflR启动子序列完全一致,寄生曲霉菌之间aflR启动子序列全部相同,但比黄曲霉菌、酱油曲霉菌、米曲霉菌多出一个碱基,同时发现不产毒黄曲霉菌株和米曲霉菌、酱油曲霉菌之间的启动子序列完全一致。通过NheⅠ酶切分析(表2)发现产毒黄曲霉菌和寄生曲霉菌都有一个酶切位点,而不产毒黄曲霉菌、米曲霉菌、酱油曲霉菌则均无NheⅠ酶切位点。分析aflR结构基因PCR扩增测序结果(表3)发现,HincⅡ酶切分析黄曲霉和寄生曲霉的aflR结构基因,黄曲霉菌有两个酶切位点,寄生曲霉有一个酶切位点;用PvuⅡ酶切分析黄曲霉和寄生曲霉的aflR结构基因,黄曲霉有一个酶切位点,寄生曲霉有两个酶切位点。测序分析结果与试验前的生物信息学分析完全一致。

图1 PCR扩增目的片段电泳图
2.3 PCR-限制性片段长度多态性分析(PCR-RFLP)
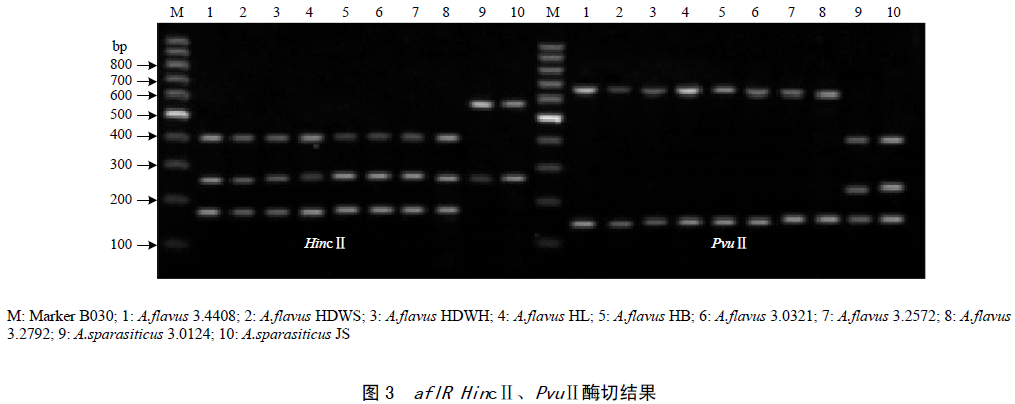
纯化后的aflR启动子片段经限制性内切酶NheⅠ消化处理;纯化后的aflR结构基因片段分别经限制性内切酶HincⅡ和PvuⅡ消化处理,电泳检测结果分别如图2、图3所示。
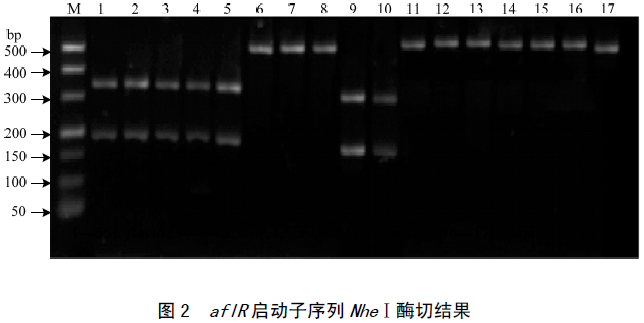
通过NheⅠ酶切,产毒黄曲霉和寄生曲霉aflR启动子序列被消化成大小为176和340bp的2个片段,而不产毒菌株没有被切开。各曲霉aflR基因启动子序列电泳检测与GenBank资源的生物信息学分析(表2)及供试菌株测序分析结果一致。因此,通过各曲霉菌株启动子序列NheⅠ酶切位点的差异,可快速鉴定区分以上各类曲霉菌株是否产毒。
鉴别区分产毒菌株后,采用HincⅡ和PvuⅡ酶切产毒黄曲霉和寄生曲霉的aflR结构基因,经HincⅡ酶切产毒黄曲霉菌aflR产生386、250和161bp的片段;而寄生曲霉为547和250bp2个片段。用PvuⅡ酶切产毒黄曲霉和寄生曲霉的aflR结构基因,产毒黄曲霉aflR酶切片段大小为652和145bp;寄生曲霉aflR基因酶切片段大小为413、239和145bp。跟预期结果完全一致(图3),同时也跟Somashekar等、邵碧英等的研究结果完全一致。表明建立的产毒黄曲霉、寄生曲霉、不产毒黄曲霉、米曲霉、酱油曲霉PCR-RFLP快速检测方法是可行的。
2.4 曲霉菌菌株产毒分析
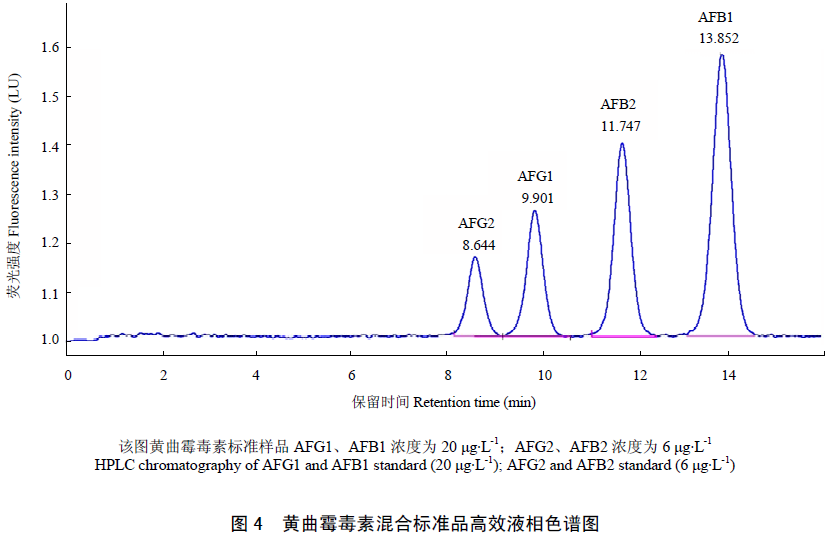
在所选用色谱条件下,黄曲霉毒素得到良好的分离,4种毒素出峰的先后顺序为AFG2、AFG1、AFB2、AFB1,图4为黄曲霉毒素标准品色谱图。
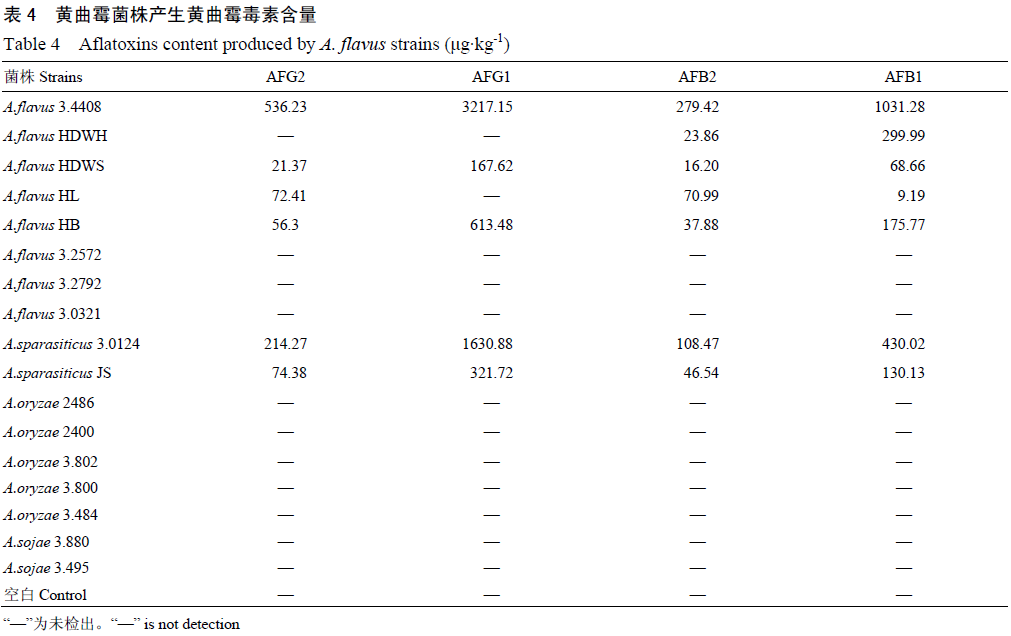
在检测过程中,黄曲霉标准菌株3.4408的毒素提取液由于产毒量太大稀释500倍,其它菌株提取液均稀释50倍。本研究中黄曲霉标准菌株A.flavus 3.4408和筛选的黄曲霉菌A.flavus ASAG3和A.flavus HDWS均检出AFG2、AFG1、AFB2和AFB1;黄曲霉菌A.fLavus HDWH检出只产AFB2、AFB1;而A.flavus 3.2572、A.flavu3.2792、A.flavu3.321没有检出黄曲霉毒素;所有的米曲霉和酱油曲霉菌均未检出黄曲霉毒素。通过HPLC检测结果,计算各曲霉菌株的产毒情况如表4。
3 讨论
通过生物信息学分析黄曲霉毒素产生相关aflR基因和启动子序列发现,采用PCR-RFLP法,首先通过NheⅠ酶切可将米曲霉菌和黄曲霉菌、寄生曲霉菌区分开来,其次通过HincⅡ和PvuⅡ酶切aflR,可将黄曲霉菌和寄生曲霉菌全区分开来。自然界中存在的黄曲霉菌中仅50%产生黄曲霉毒素,在分析中发现黄曲霉菌和米曲霉菌的aflR相似度极高,为99.35%。1987年Kurtzman等通过对黄曲霉菌、寄生曲霉菌、米曲霉菌和酱油曲霉菌的DNA同源性研究表明4种菌株之间互补性极高,因此认为这些菌株都是同一种内不同形态和生理的变异株。1999年Waston等利用Southern blot技术检测到黄曲霉菌和酱油曲霉菌都有aflR存在,2000年刘钟滨等成功将米曲霉菌的aflR启动子序列克隆,虽然黄曲霉菌和酱油曲霉菌在染色体上有aflR结构基因,但是没有检测到aflR的转录产物,同时也没有检测到黄曲霉毒素的产生。
以此为研究背景,推测不产毒黄曲霉菌是否也发生类似米曲霉菌的突变而不具备有产毒能力。最终通过采用PCR-RFLP法快速准确地鉴别黄曲霉菌是否能够产生黄曲霉毒素,同时可以快速鉴定区分黄曲霉菌和寄生曲霉菌。传统的黄曲霉毒素产生菌株的鉴定方法主要通过产毒试验完成,但存在产毒周期长、产毒条件不稳定、操作繁琐,不仅耗时、费力,而且检测成本高,且不能对菌株是否产毒进行准确的判定。本研究除各曲霉的摇瓶培养需要时间较长(约3d)外,从菌株的DNA提取、PCR到RFLP鉴定整个过程可在1d内完成。由于此方法对各曲霉菌株是否产毒的鉴定具有灵敏、特异、快速、简便等优点,大大缩短了检测周期,提高了鉴别效率,降低了黄曲霉毒素污染的潜在风险,比传统的鉴定方法更节省时间。黄曲霉毒素主要是由黄曲霉和寄生曲霉产生的,在工业发酵中黄酒的酿造、大豆酱的制造过程中黄曲霉菌应用广泛,如何快速鉴定所使用的菌株是否产毒至关重要。
由于菌种资源有限,本研究仅对十几株曲霉属菌株进行了研究,下一步希望针对更多来源不同的菌株开展试验,更加充分地证明本技术的可靠性和准确性。可以在粮食的储藏初期,为储藏粮食中存在的潜在危险进行早期预警;为粮油食品中潜在产生黄曲霉毒素的菌株鉴别、食品发酵工业菌株的选育、安全应用提供实用、快速的理论基础和方法依据;为黄曲霉菌在工业发酵、黄酒的酿造、大豆酱的制造过程以及黄曲霉毒素污染的生物防治中的广泛应用,提供不产毒菌株原料的筛选和检测理论和试验依据。
4 结论
通过对基因序列的生物信息学分析和对可能产毒菌株的产毒能力的验证研究,最终的检测结果与限制性片段长度多态性分析结果相吻合,验证了PCR-RFLP法对黄曲霉毒素可能产生菌株快速鉴定的可行性。结果表明,对黄曲霉毒素合成的关键调控基因aflR启动子片段的NheⅠ位点分析可以快速、准确判别菌株是否具有黄曲霉毒素产生能力,对aflR结构基因的PvuⅡ和HincⅡ位点分析,实现寄生曲霉和黄曲霉进一步的快速区分。
| 相关附件 |


